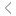- 首页
- >
- GENESEED
- >
科锐迈德/康普瑞团队利用甘油基LNP递送编码FGF18的circRNA改造间充质干细胞,促进关节炎模型大鼠软骨修复
骨关节炎(OA)是一种复杂的退行性关节疾病,已成为老年人群中的严重致残疾病,影响超5亿人。骨关节炎发病机制的一个显著特征是关节软骨的进行性分解,由软骨细胞中合成代谢和分解代谢过程之间的失衡所驱动。抗炎药和镇痛药等药物治疗主要提供症状缓解,而不会逆转潜在的疾病进程。
间充质干细胞(MSCs)因其再生能力和免疫调节能力,可作为OA的潜在治疗方法。通过基因工程进行编辑的MSCs将获得释放多种细胞因子的能力,有效促进组织的修复和再生。FGF18蛋白已被证明可以增强软骨再生,在大鼠半月板撕裂模型中减缓软骨退化。然而,结合FGF18与MSCs进行OA修复治疗的研究仍较少。其中最主要的原因在于MSCs固有的“难以转染”特性使得其工程化改造存在障碍。基于mRNA-LNP的细胞工程因其良好的设计灵活性和生物相容性得到了广泛关注。通过合理设计可以获得专用于转染MSCs的脂质纳米颗粒(LNP),使得MSCs的工程化设计成为可能。
2024年7月22日,苏州科锐迈德、江苏普瑞康生物联合澳大利亚莫纳什大学研究团队在Biomaterials Science上发表了题为“FGF18 encoding circular mRNA-LNP based on glycerolipid engineering of mesenchymal stem cells for efficient amelioration of osteoarthritis”的研究论文。研究团队通过三步酯化反应合成了一种具有支链尾部和五个酯键的专有可电离甘油脂质,称为TG6A。使用该脂质构建的LNP成功向MSCs转染了编码FGF18蛋白的环状RNA(cmRNA),在大鼠OA模型中显著促进了软骨修复,有望成为治愈OA的候选疗法。

TG6A-LNP的制备和表征
通过三步酯化反应合成了一种可生物降解和可电离的甘油脂质TG6A,其分子结构包括叔胺头基、甘油连接子和支链烷烃尾部(图1A)。TG6A-LNP由TG6A、DOPE、胆固醇和DMG-PEG以摩尔比为50:10:38.5:0.75配制而成,并通过甘油脂(N)的可电离胺基团和cmRNA分子的磷酸基团(P)之间的静电相互作用包封编码eGFP报告基因的cmRNA,以评估LNP在MSCs中的转染效率。
制备所得的TG6A-LNPs平均粒径为116 nm,粒径分布较窄,多分散指数(PDI)为0.05,冷冻电子显微镜图像显示球形形貌相对均匀(图1B)。包封效率为93%,zeta电位为中性(图1C)。转染实验表明,与MC3和ALC-0315的商业LNP相比,TG6A-LNP的EGFP表达显著更高(图1D-F),分别约为9倍和41倍。TG6A富集的酯键具有极好的降解性,在进入MSCs细胞质时能够快速降解,促进mRNA释放和蛋白质表达。
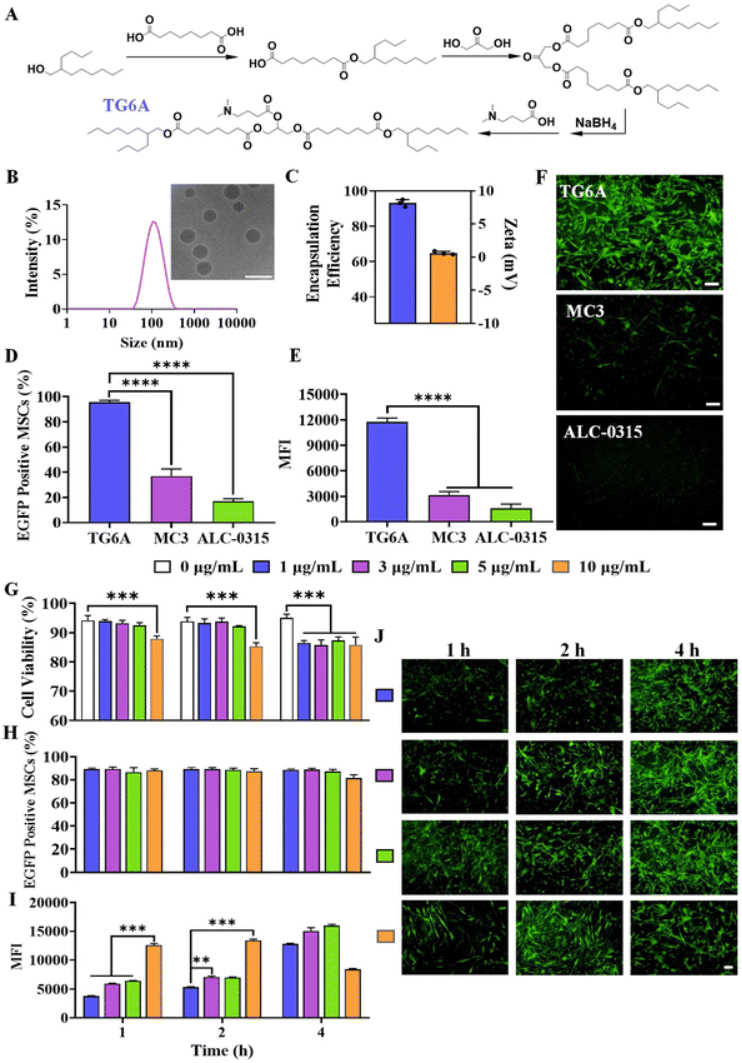
图1. TG6A的特性和TG6A-LNP在MSCs中的转染效率
流式细胞术分析表明,EGFP阳性MSCs的百分比和荧光强度与N/P比成正比增加,近似的N/P比为6:1。所有组中约有90%的MSCs被转染,荧光强度的增加与转染时间的延长相关。值得注意的是,以10μg mL−1的浓度转染4小时荧光强度降低,可能是由于细胞毒性增加。考虑到细胞毒性问题,以及当cmRNA浓度从3μg mL−1增加至5μg mL−1时荧光强度缺乏实质性增强,浓度为3μg mL−1并选择2 h的孵育时间为最佳条件(图1H-J)。
FGF18-LNP体外转染和细胞功能分析
使用FGF18 cmRNA负载的TG6A-LNP(FGF18-LNP)或EGFP cmRNA负载的 TG6A-LNP(EGFP-LNP)处理的MSCs以及未经处理的MSCs以确定cmRNA-LNP工程MSC的细胞功能。如图2A所示,用FGF18-LNP(FGF18-MSCs)改造的MSCs上清液中FGF18的浓度达到19 ng mL−1,而在未经处理的MSC或用EGFP-LNP(EGFP-MSC)处理的MSC中检测不到,这表明FGF18-MSC能够产生高水平的生物功能FGF18蛋白。
接下来,测量了表面标记物的表达以评估工程化间充质干细胞是否保留了其固有的生物学功能。其中FGF18-MSCs高表达间充质标志物,包括CD73、CD90、CD105和HLA-ABC(>95%),而对CD14、CD19、CD34、CD45和HLA-DRDPDQ等标志物保持阴性(<2%),表明工程化转染仍维持了间充质干细胞的正常表型。

图2. FGF18-MSCs的功能分析
将FGF18-MSC与外周血单核细胞(PBMC)共培养确定FGF18-MSC的免疫调节作用。FGF18-MSCs显著抑制淋巴细胞增殖,并促进了Treg细胞的比例,与未经工程化的MSC没有显著差异。此外,PBMC中Th1细胞和Th17细胞的表达受到FGF18-MSC的抑制,淋巴细胞+FGF18-MSCs组观察到更高的下调比率,同时抑制TNF-α的表达。这些结果表明,FGF18-LNP转染的MSCs保留甚至增强了MSC的免疫调节能力。
在此基础上,进一步研究了FGF18-MSCs的增殖和软骨分化潜力。如图2B所示,随着培养时间的增加,所有基团都表现出优异的增殖行为。EGFP-MSCs表现出与未修饰MSCs相当的增殖能力,而FGF18-MSCs从第3天开始表现出更显著的生长速度。这些发现表明,TG6A-LNP递送系统不会损害MSCs的增殖,FGF18的表达似乎可以增强细胞增殖。
在软骨生成培养基中培养上述各类型的间充质干细胞,诱导7天。与未处理的MSCs和EGFP-MSCs相比,FGF18-MSCs的软骨生成基因表达水平显著增加,包括II型胶原α1(Col-2a1)和聚集聚糖(ACAN)(图2C和D)。有趣的是,BCL6在FGF18-MSCs中的基因表达上调,表明在软骨分化的初始阶段抗凋亡过程增强(图2E)。
此外,培养21天后,使用DMMB测定法和阿尔新蓝染色评估软骨基质成分糖胺聚糖(GAG)。定量分析显示,与未处理的MSCs和EGFP-MSCs相比,FGF18-MSCs显著增加了GAG的生成(图2F)。染色结果同样显示,FGF18-MSCs在阳性染色的面积和强度上均显著增强(图2G)。表明,FGF18-MSCs具有增强的软骨生成分化特性。
FGF18-MSC对软骨细胞的影响
为了阐明FGF18-MSCs对软骨细胞功能的影响,在培养24小时后收集无细胞上清液。然后将单层培养物中的软骨细胞在这些上清液中孵育,以评估其增殖能力。值得注意的是,在FGF18-MSCs衍生的上清液中培养的软骨细胞表现出显著增强的增殖行为(图3A),表明FGF18-MSCs分泌的FGF18在促进软骨细胞增殖中起着关键作用。
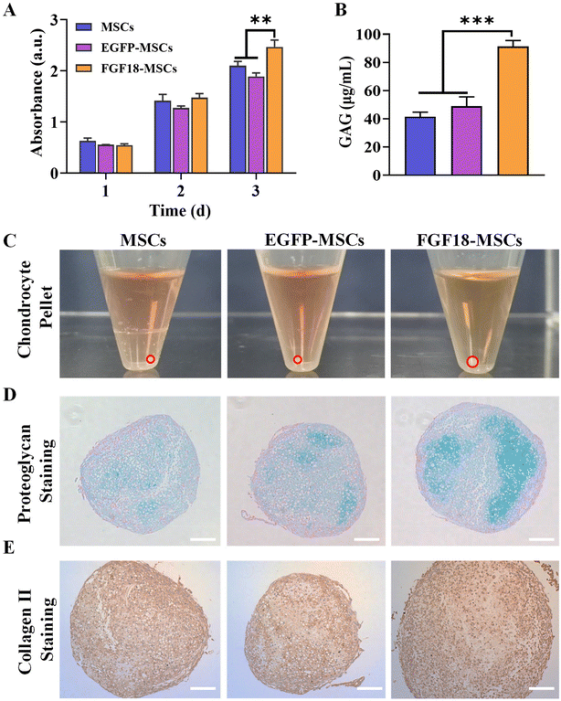
图3. FGF18-MSCs细胞上清液对软骨细胞的影响
将软骨细胞沉淀在上述相同条件下培养21天,与未经处理的MSCs和EGFP-MSCs组相比,在FGF18-MSCs上清液中培养的沉淀物体积显著增加(图3C)。此外,FGF18-MSCs处理的软骨细胞沉淀中,蛋白聚糖的沉积量较高,表现为强烈的阳性染色(图3D)所示。此外,在FGF18-MSCs组中观察到明显的软骨间隙生成。GAG的定量分析证实,在FGF18-MSCs的上清液中培养的沉淀产生了更多的细胞外软骨基质(图3B)。II型胶原的免疫组织化学染色显示,所有组均有明显的阳性染色,与未处理MSCs和EGFP-MSCs组相比,FGF18-MSCs组的染色强度显著升高(图3E)。这些发现明确表明,FGF18-MSCs中FGF18的过表达不仅刺激软骨细胞增殖,而且增强了其合成代谢作用。
对OA大鼠的治疗作用
研究继续在体内进一步评估FGF18-MSCs对OA愈合的疗效。通过前交叉韧带横断(ACLT)手术建立OA模型,然后每两周向OA大鼠膝关节内注射单一透明质酸(HA),或含有悬浮MSCs或FGF18-MSCs的透明质酸(图4A)。OOCHAS评分用以表示软骨侵蚀程度,0分代表正常软骨,分数越高代表关节退化越严重。
Safranin-O/fast green染色显示,对照组关节软骨明显减少,显示软骨侵蚀(图4C)。单一HA组和空白对照组在Safranin-O染色方面没有显著差异,表明单一HA注射的治疗效果有限(图4B和C)。在MSCs组中观察到轻度软骨损伤,其特征是软骨表面较薄,Safranin-O染色减少。而FGF18-MSCs HA显著保留了软骨,表现为更厚的软骨和增加的safranin-O染色,这与FGF18-MSCs组的OOCHAS评分降低一致。
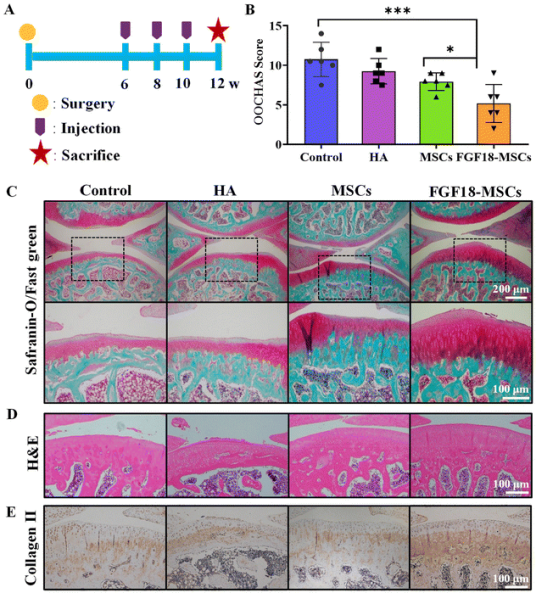
图4. FGF18-MSCs对OA大鼠的治疗效果
此外,如图4D所示,对照组的软骨区域结构完全紊乱,软骨细胞显著减少。FGF18-MSCs的移植有利于软骨细胞的存活,并且区域结构在很大程度上得以维持。通过免疫组化染色评估了天然关节软骨中II型胶原蛋白的表达水平(图4E)。用FGF18-MSCs治疗后,新生组织沉积了更多的II型胶原和ECM,表明软骨损伤的功能修复。
总的来说,这些结果表明,FGF18-MSCs的移植为增强OA患者的软骨修复和再生提供了一种有前途的治疗策略。
总结
本研究表明,基于甘油脂质的TG6A-LNP核酸递送系统可作为间充质干细胞基因工程的重要平台。以该平台工程化的FGF18-MSCs不仅表现出优异的软骨细胞增殖和分化能力,同时实现分泌FGF18蛋白的功能,从而改善体内软骨细胞退行性病变,有望达到治愈骨关节炎的目的。
需要注意的是,mRNA-LNP工程化MSCs用于OA治疗构成了一个长期且复杂的生物学过程,未来的努力应优先考虑以下几个方面:首先,通过cmRNA TG6A-LNP的策略可以实现MSCs多方面的工程改造,例如赋予分泌多种抗炎细胞因子(IL-1Ra和IL-10)和营养因子(TGF-β1和IGF-1)的功能。其次,必须对与TG6A-LNP和工程化间充质干细胞相关的安全性问题进行更详尽的评估。最后,可探索基于外泌体递送cmRNA改造MSC的治疗作用,提供更多安全可行的工程化方案。
参考资料
Huang K, et al., FGF18 encoding circular mRNA-LNP based on glycerolipid engineering of mesenchymal stem cells for efficient amelioration of osteoarthritis. Biomater Sci. 2024 Jul 22. doi: 10.1039/d4bm00668b.


左炽健丨科锐迈德联合创始人
左炽健博士,苏州科锐迈德生物医药科技有限公司联合创始人、副总经理。博士毕业于德国弗莱堡大学药学系。目前主要从事环状RNA平台建设,包括新的成环框架的研发,环状RNA功能元件的筛选及优化,以及环状RNA工艺/生产开发研究,已建立国内领先的环状RNA平台。同时将环状RNA与多种递送技术相结合,应用于肿瘤免疫药物、传染病疫苗、肿瘤疫苗等项目开发。左炽健博士确认出席第八届circRNA研究与产业论坛,并发表主题演讲,敬请期待!