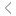- 首页
- >
- GENESEED
- >
环状RNA:打造基因编辑疗法创新的“双重引擎”
◆ ◆ ◆ ◆
基 因 编 辑
难治疾病的根源性精准疗法
◆ ◆ ◆ ◆
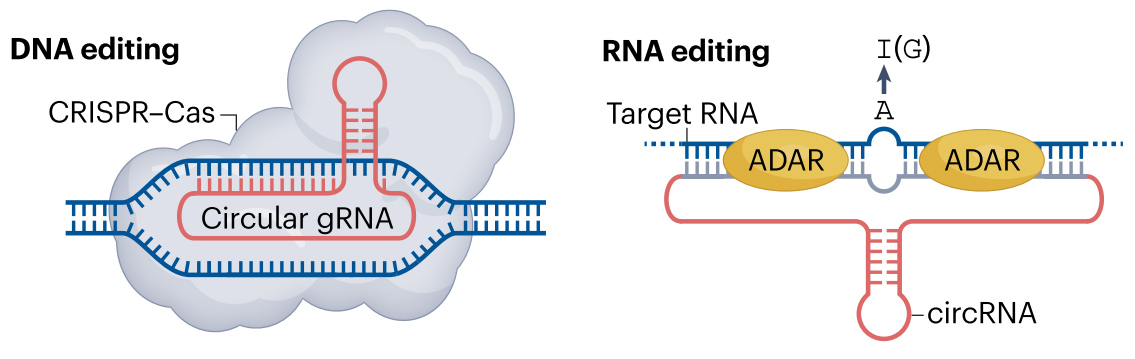
基因编辑技术可以对DNA与RNA层面的遗传信息实现精准、高效、定向调控,在疾病治疗、遗传育种、科学研究等领域中展现出巨大的潜力。
在疾病治疗应用中,DNA编辑能够从源头上永久性修正致病突变,而RNA编辑凭借其可逆、瞬时的调控特性,在需动态干预的疾病中展现出独特的治疗潜力。DNA和RNA编辑策略,覆盖了从遗传缺陷纠正至表型调控的广谱疾病类型,通过时空特异性干预实现了治疗窗口的精准扩展。
DNA编辑技术已建立起较为完整和成熟的研发管线。全球首款获批上市的基因编辑疗法Casgevy(exagamglogene autotemcel),由Vertex Pharmaceuticals与CRISPR Therapeutics共同开发,2023年相继在英国与美国获批。该疗法通过对患者自体造血干细胞进行基因编辑,提升胎儿血红蛋白表达水平,用于治疗输血依赖型β地中海贫血和镰状细胞病。
DNA编辑技术及其核心机制[1]
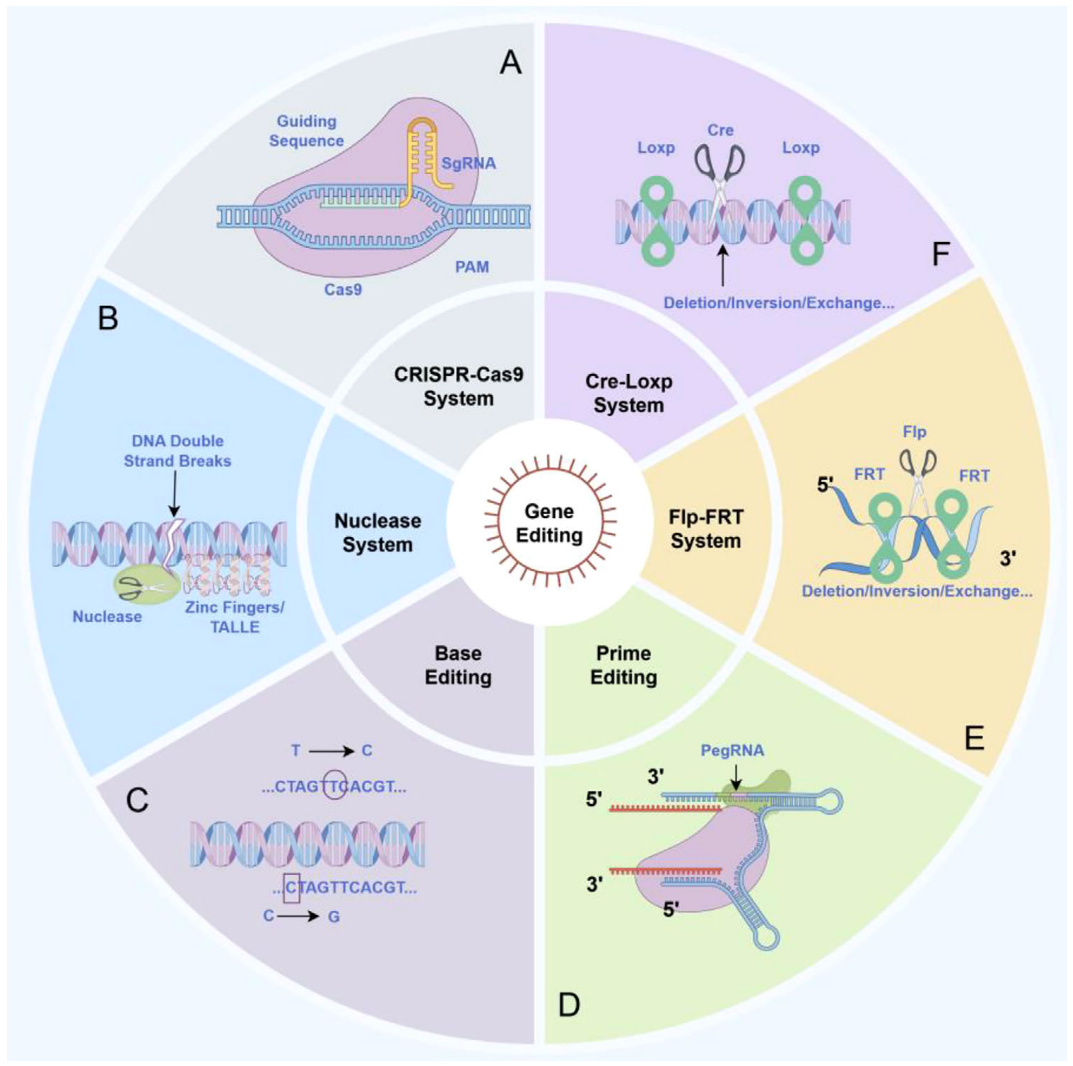
而RNA编辑作为新兴方向,目前多数项目仍处于临床前或早期临床阶段。代表性的管线有Wave Life Sciences开发的WVE-006,作为首个进入临床阶段的RNA编辑疗法,旨在治疗α1-抗胰蛋白酶缺乏症(AATD)。WVE-006是一种经化学修饰的短链寡核苷酸(AIMer),可引导细胞内源性ADAR对目标mRNA中的特定错义突变进行精准的A-to-I编辑,从而恢复功能性蛋白的表达。目前已公布的临床数据显示了该疗法良好的安全性与初步有效性证据。
RNA编辑技术及其核心机制[1]
◆ ◆ ◆ ◆
R N A
基因编辑疗法的优越平台
◆ ◆ ◆ ◆
基因编辑技术迈向临床的核心挑战之一是开发高效的递送形式,以确保编辑系统的稳定性和安全性。目前,基因编辑系统主要通过以下形式递送:
① 质粒DNA载体:利用病毒载体将表达基因编辑工具酶和引导RNA的质粒递送至细胞核。
优势:表达相对持续长效,编辑能力较强。
劣势:存在基因组整合与持续性表达风险,可能导致更严重的脱靶效应;病毒包装流程复杂,大尺寸蛋白(如Cas9)包装困难;病毒载体可能具有免疫原性。
② RNA/蛋白复合物(RNP):通过电穿孔、微流控等物理方式递送基因编辑工具酶和引导RNA复合物。
优势:作用迅速、剂量可控,无基因组整合风险。
劣势:复合物稳定性差,易降解;蛋白纯化工艺复杂、成本高,存在内毒素污染风险;物理递送方式多限于体外应用,且可能引起细胞膜损伤与毒性反应。
③ RNA复合物:利用纳米脂质颗粒(LNP)等非病毒载体递送表达基因编辑工具酶的mRNA和引导RNA。
优势:mRNA研发和生产快捷;无需进入细胞核即可表达,起效快;瞬时表达避免基因组整合,安全性较高。
劣势:线性mRNA不稳定,很容易降解。
mRNA-LNP形式在疗效、研发、生产及商业化中均体现卓越的优势,更驱动了体内基因编辑疗法的发展,拓宽了基因编辑在疾病治疗中的应用范围,成为当前基因编辑疗法开发的前沿平台。
全球已有多个基于mRNA的体内编辑疗法进入临床试验阶段。
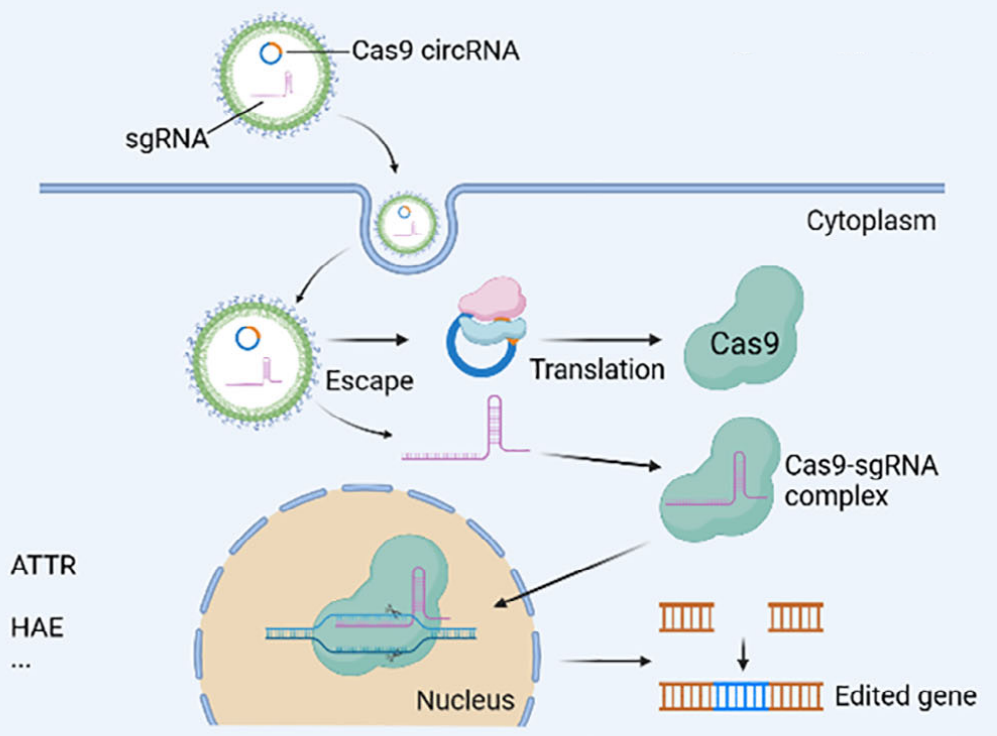
例如,Intellia Treeutics与Regeneron联合开发的体内CRISPR基因编辑疗法NTLA-2001,通过LNP将gRNA和Cas9 mRNA递送到遗传性转甲状腺素淀粉样变性(ATTR)病人体内,全部敲除ATTRv和ATTRwt基因,实现一次性“治愈”,而不是终身服药。NTLA-2001正开展临床Ⅲ期研究,是目前进展最快的基于mRNA的体内基因编辑疗法。
今年5月,费城儿童医院与宾夕法尼亚大学医学院团队报告了一项突破性研究:全球首次通过基于mRNA的个性化体内CRISPR基因编辑疗法,成功治愈一名严重的氨甲酰磷酸合成酶-1(CPS1)缺乏症的婴儿。该疗法针对患者CPS1基因中的Q335X突变,设计特异性腺嘌呤碱基编辑器(ABE),并利用LNP将编码该编辑器的mRNA导入患者肝细胞进行基因编辑治疗。该研究从诊断到完成治疗全程仅历时六个月,标志着个性化mRNA CRISPR技术实现临床转化的重大里程碑。[2]
◆ ◆ ◆ ◆
环 状 R N A
基因编辑疗法的升级平台
◆ ◆ ◆ ◆
线性mRNA在基因编辑应用中面临稳定性差、潜在免疫原性和作用时间短等限制,可能会导致编辑效率低、编辑范围小、脱靶效应高等问题。
环状RNA(circRNA)作为新一代RNA疗法的热门分子,因其独特的共价闭环结构,为上述挑战提供了新一代解决方案,其核心优势包括:
① 功能多样:一种技术平台实现基因编辑系统的两种主要组分的研发和生产升级。circRNA兼具编码与非编码功能,既可替代线性mRNA表达基因编辑器,亦可设计作为引导RNA。
② 性能优越:优化线性mRNA形式容易降解的问题。circRNA闭环结构显著提升RNA稳定性,作为编码RNA,可以延长编辑工具酶的表达窗口与有效编辑时间,从而提高编辑能力;作为非编码RNA,延长引导RNA的半衰期,并提供特定的拓扑结构,有助于提升编辑效率与精确度。
③ 安全性高:规避线性mRNA的免疫原性问题。circRNA缺乏病原体识别受体识别序列,不易被天然免疫受体识别,免疫原性极低,有利于提高基因编辑疗法的安全性;
④ 工艺简化:免除线性mRNA的复杂原料和繁琐工艺。circRNA无需加帽、加尾及核苷修饰等步骤,工艺简化有望降低生产成本,提高体内基因治疗的可及性。
环状RNA在基因编辑应用中的优势,已获多项研究实证支持。其作为引导RNA与编辑器载体的双重功能,协同提升了编辑系统的效率、稳定性、精准性与安全性,展现出作为新一代基因编辑疗法创新平台的卓越性能。
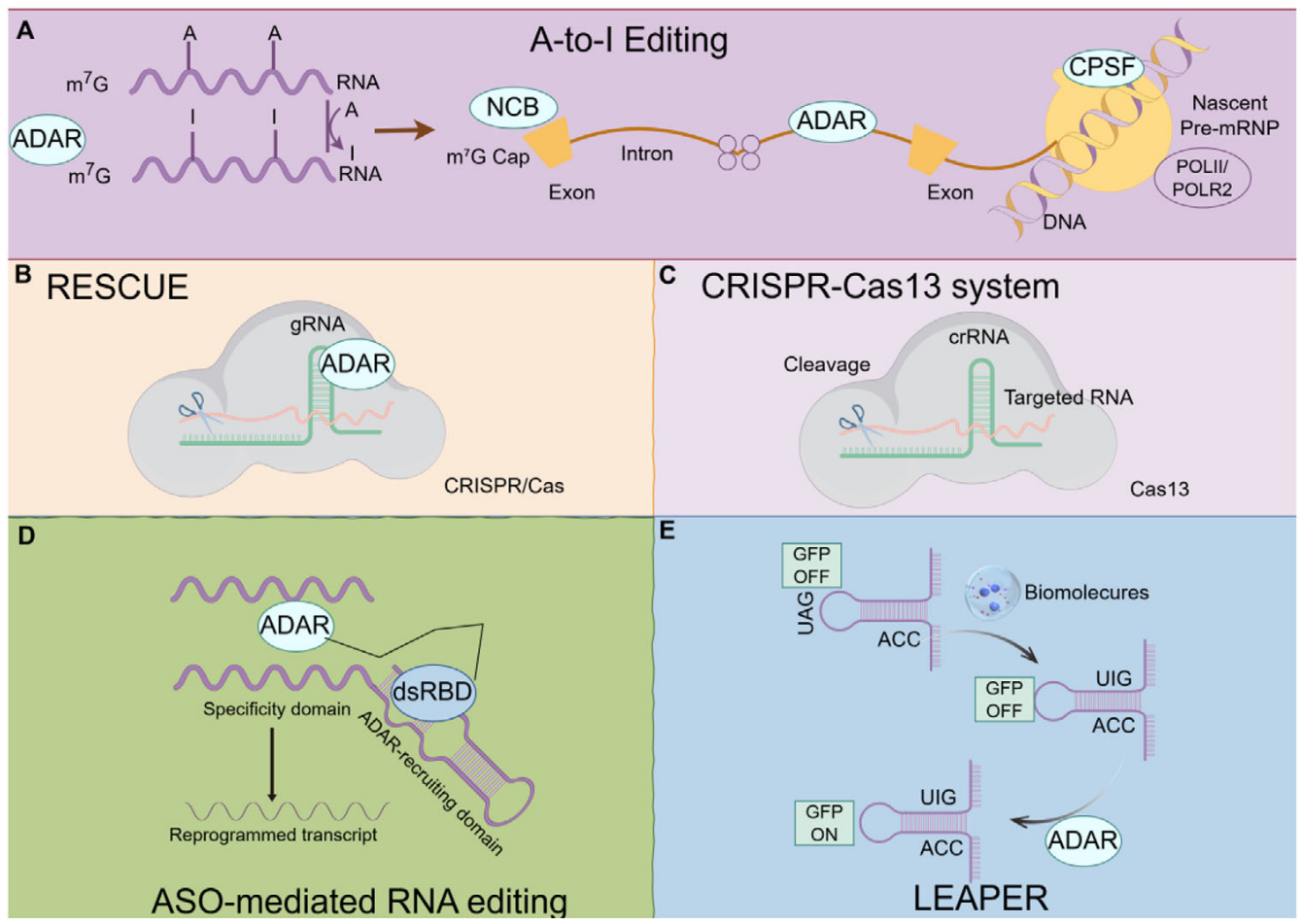
circRNA编码Cas9介导基因编辑[3]
circRNA作为引导RNA介导基因编辑[4]
环状mRNA
稳定长效可控表达编辑器
昌平实验室/北京大学魏文胜团队通过体外合成工程化环状RNA,编码优化的线粒体碱基编辑器mitoBE v2,并将其显微注射至小鼠胚胎中,实现了效率达82%的高精度线粒体DNA编辑。编码mitoBE v2的环状RNA介导的编辑效率显著高于传统线性mRNA形式。该研究为线粒体疾病模型的构建、机制解析及治疗策略开发提供了高效、精准的技术路径。
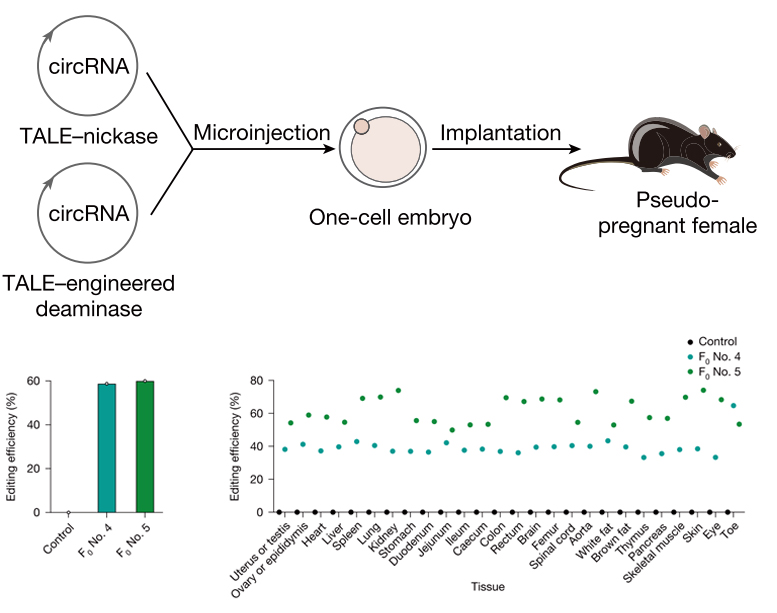
mitoBE v2编辑的小鼠出生2个月后不同组织的编辑效率[5]
美国加州大学Prashant Mali团队利用细胞内环化生成的环状RNA,在HeLa细胞中表达了融合3A3L DNA甲基转移酶与ZF-KRAB蛋白的表观调控模块3A3L-ZF-KRAB,12天内实现了对PCSK9基因(心血管疾病风险相关)的高效沉默。另外,研究团队还设计了编码dSpCas9 CRISPRoff系统的环状RNA,与sgRNA共转染至HEK293T细胞,成功实现对B2M基因的特异性转录抑制。
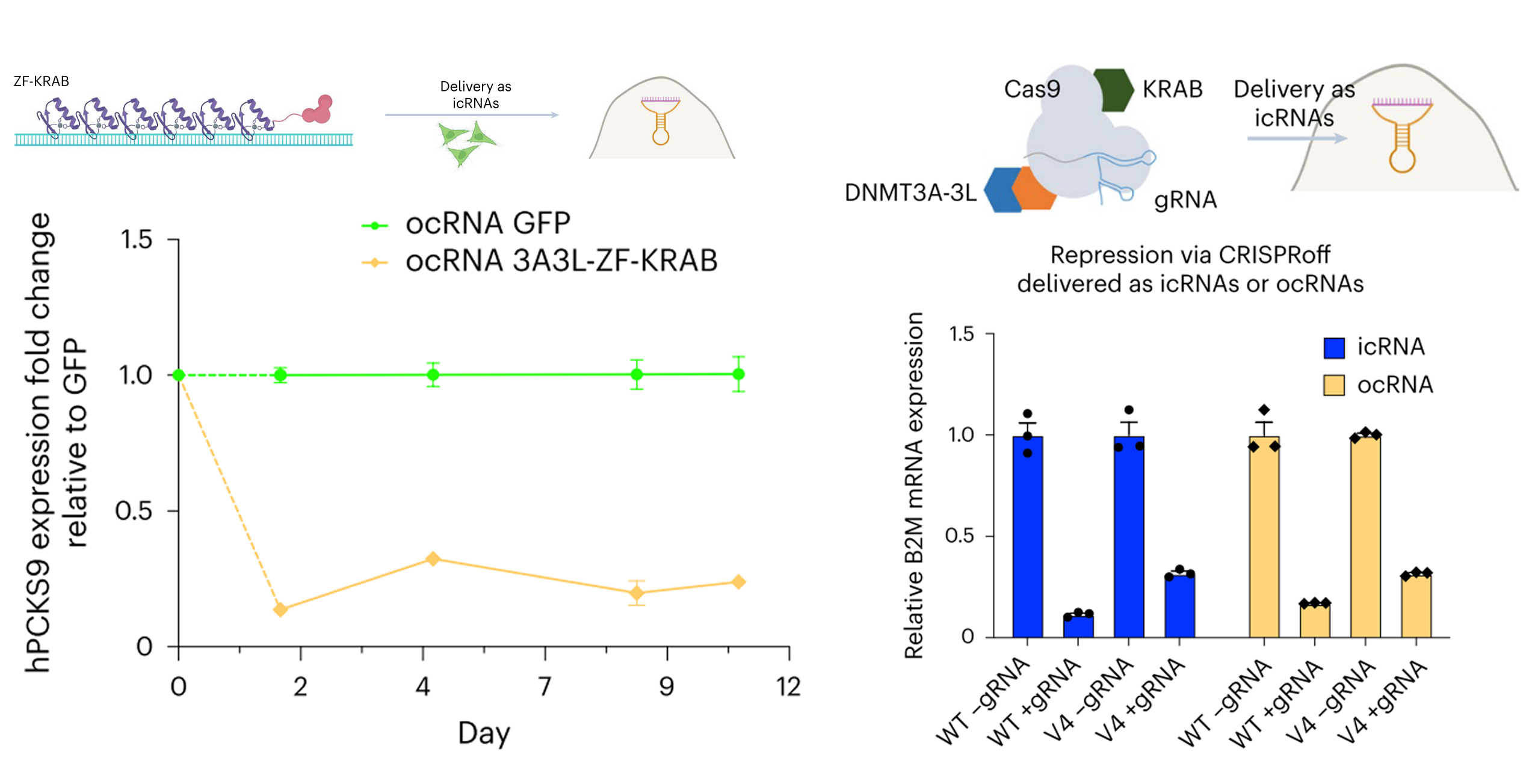
circRNA介导的3A3L-ZF-KRAB与dSpCas9 CRISPRoff系统在细胞中的编辑效率[6]
环状引导RNA
介导精准高效安全的编辑
介导DNA编辑
中国科学院遗传与发育生物学研究所高彩霞团队开发了基于Cas12a的环状先导编辑器系统(CPE)。该系统将线性pegRNA中的引物结合位点(PBS)与逆转录模板(RTT)环化,显著提升了RTT-PBS的稳定性,进而提高了Cas12a系统的先导编辑效率。研究进一步将多个RTT-PBS单元整合至单一环状RNA中,实现了多达四个基因的同时编辑。该体系在生物医学研究、疾病治疗及作物育种等领域展现出重要的应用潜力。
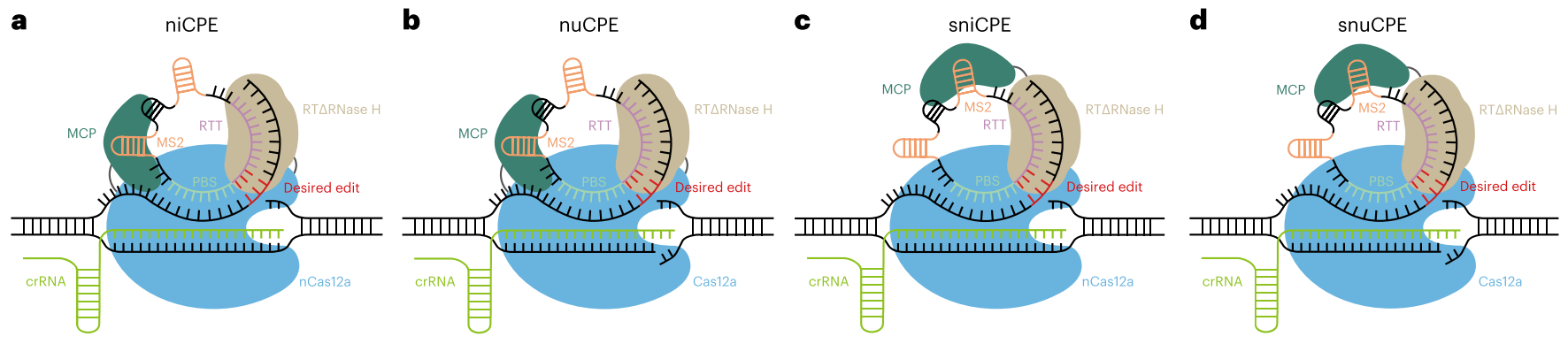
CPE编辑器示意图[7]
在此基础上,高彩霞团队还利用靶向链切口酶nCas9-D10A、逆转录酶开发了环状RNA引导的反向引导编辑器(ciPE)系统,协同使用解旋酶Rep-X,将编辑效率提高到2.7%-55.4%,拓宽了可编辑基因的范围,同时展现了较高的编辑效率和安全性。
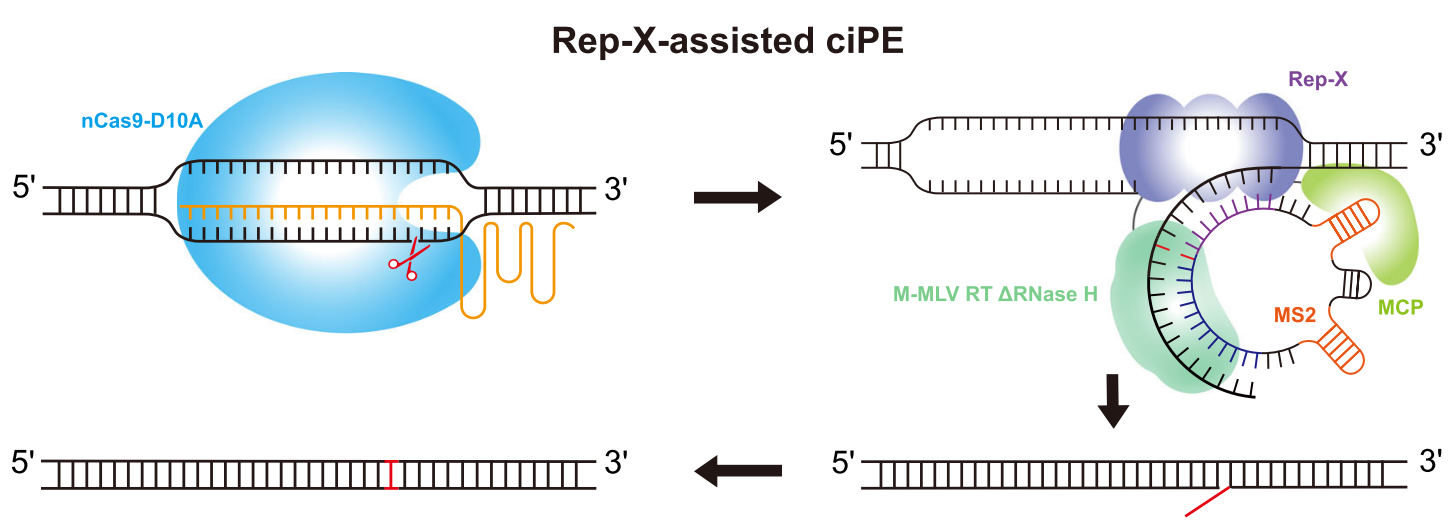
REP-X辅助的ciPE系统[8]
南方医科大学荣知立、林瑛团队基于Cas12f,设计了环状gRNA(cgRNA),显著提升了基因编辑系统的性能。研究表明,cgRNA将基因激活效率提高约1.9-19.2倍;与相分离系统联用时,激活效率进一步提高2.3-3.9倍。此外,cgRNA还使腺嘌呤碱基编辑的编辑窗口缩小了1.2-2.5倍。在小鼠模型中,通过水动力尾静脉注射(HTVI)递送cgRNA质粒,在小鼠肝脏中介导基因激活效率比常规gRNA高3.3-19.3倍,充分展现了cgRNA在基因编辑治疗领域的应用潜力。
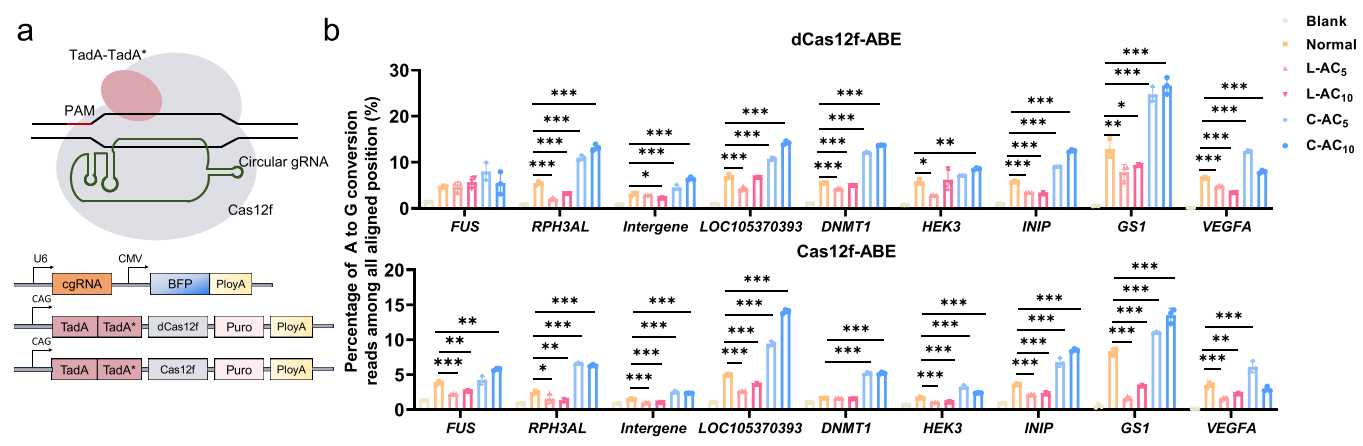
cgRNA介导Cas12f在HEK293T细胞中的对不同靶点的A-G碱基编辑效率[9]
介导RNA编辑
北京大学生命科学学院魏文胜团队开发了基于内源性ADAR的RNA编辑系统(LEAPER),在此基础上,进一步开发了升级版LEAPER 2.0:通过设计环状arRNA(circ-arRNA),显著提升编辑性能。在体外细胞实验中,circ-arRNA介导的LEAPER 2.0编辑效率显著提高,达线性arRNA的3.1倍,且编辑效果可维持长达21天。在Hurler综合征小鼠模型中,AAV递送的circ-arRNA,成功纠正致病点突变,恢复α-L-艾杜糖苷酶催化活性,并有效降低肝脏中糖胺聚糖的异常积累。
魏文胜教授作为科学创始人成立的博雅辑因基于LEAPER系统,建立了体内RNA碱基编辑疗法的多条管线,正针对α-L-抗胰蛋白酶相关肝病(AATD)、Usher综合征Ⅱ型、杜氏肌肉营养不良(DMD)等疾病开发创新疗法,目前分别处于临床前研究及IND准备阶段。
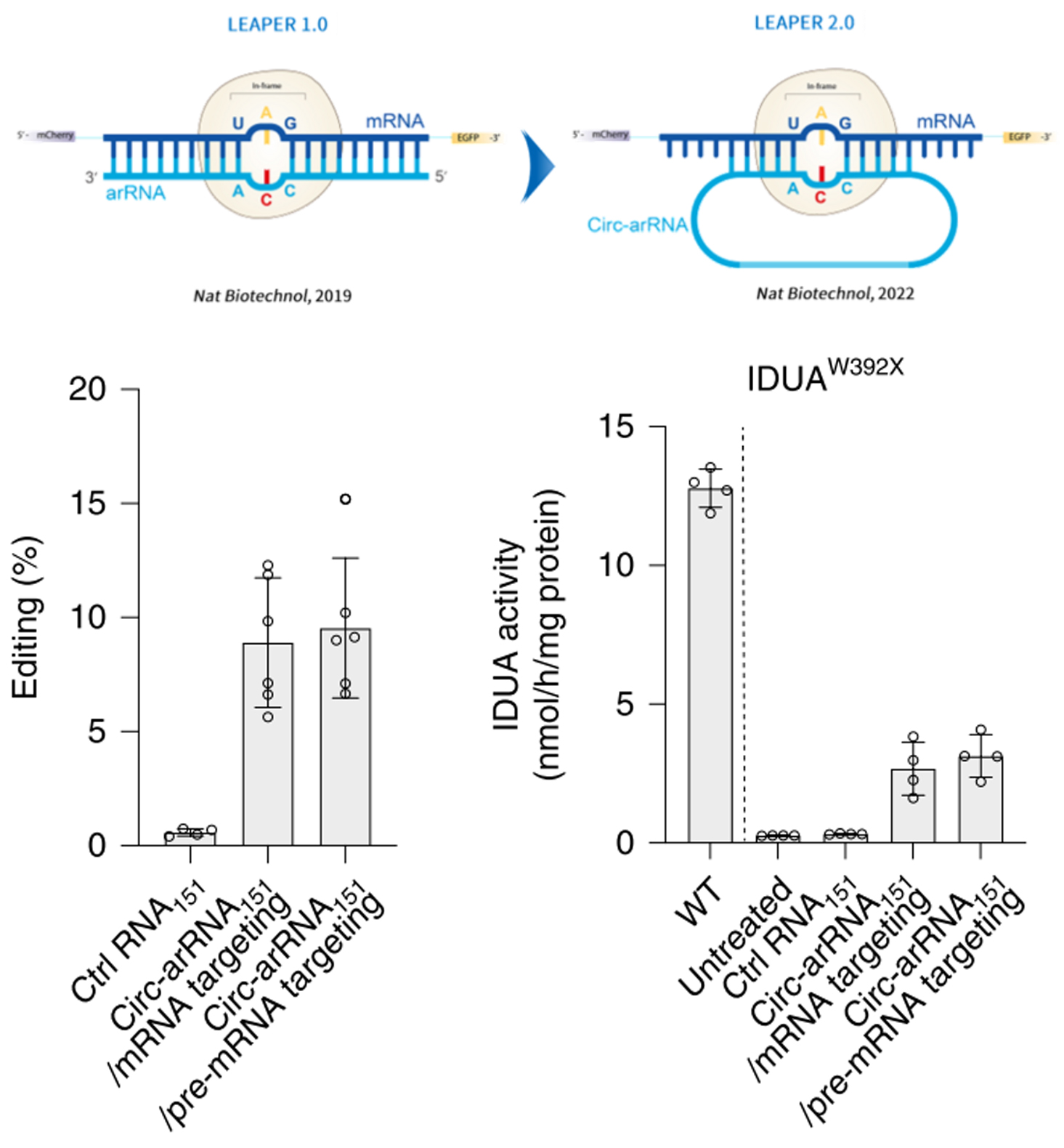
LEAPER系统的示意图[10];circ-arRNA在小鼠干细胞中靶向IDUA的编辑效率及IDUA的催化活性[11]
美国加州大学Prashant Mali团队同期发表的研究,通过设计可招募ADAR的环状引导RNA(cadRNA),显著提升了RNA编辑的效率与持久性,并有效降低了旁观者编辑效应。经AAV体内递送的cadRNA,对小鼠肝脏中mPCSK9转录本实现了高达53%的靶向编辑;在粘多糖贮积症I型Hurler综合征的IDUA-W392X小鼠模型中,成功对UAG无义突变完成12%的UAG-to-UGG校正。研究证明了cadRNA性能优于传统线性引导RNA,在蛋白质功能调控及基因治疗领域具有广泛的应用潜力。
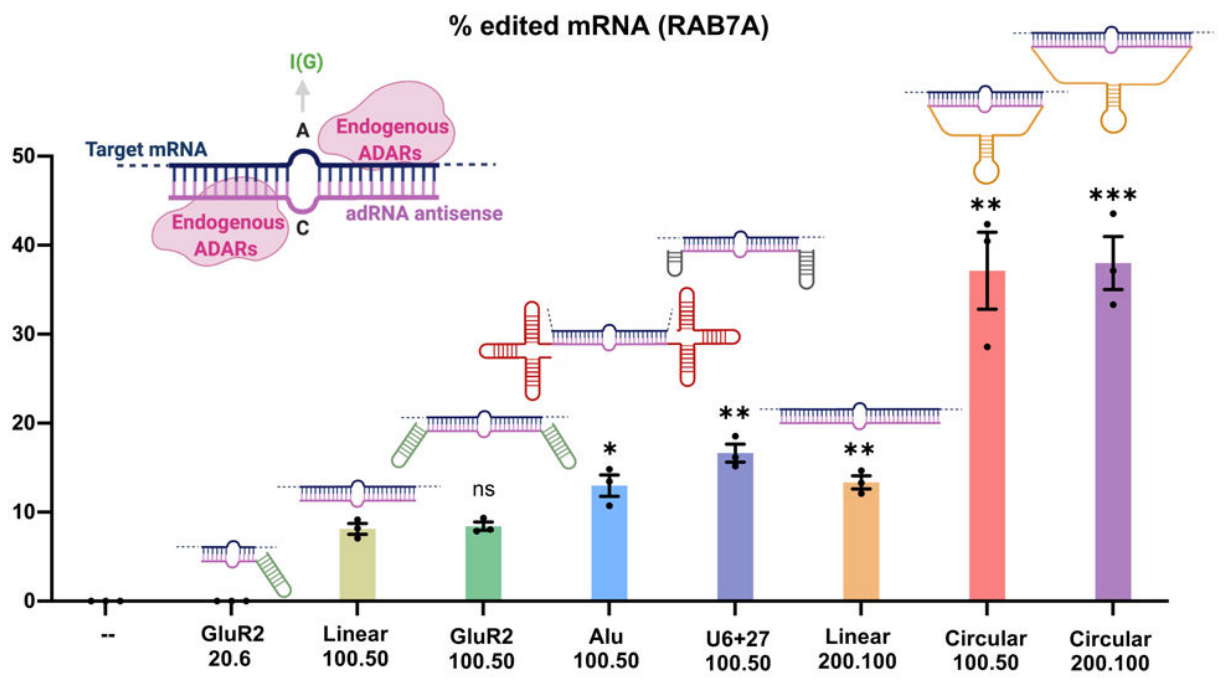
不同设计的adRNA介导RAB7A mRNA的编辑效率[12]
郑州大学张开翔、梁燕团队开发了一种可招募内源性ADAR的环状arRNA(Circ-arRNA)。相比线性arRNA,Circ-arRNA在细胞内展现出显著更优越的稳定性与编辑效率,且未在旁观者碱基位置检测到脱靶编辑。在三阴性乳腺癌TP53-W53X 4T1细胞及荷瘤小鼠模型中,LNP递送的Circ-arRNA,分别实现73.32%与48.48%的突变校正效率,并成功恢复了全长P53蛋白的表达与转录活性,显著增强荷瘤小鼠对紫杉醇化疗的敏感性,显示出Circ-arRNA在无义突变纠正及相关疾病治疗中的良好应用前景。
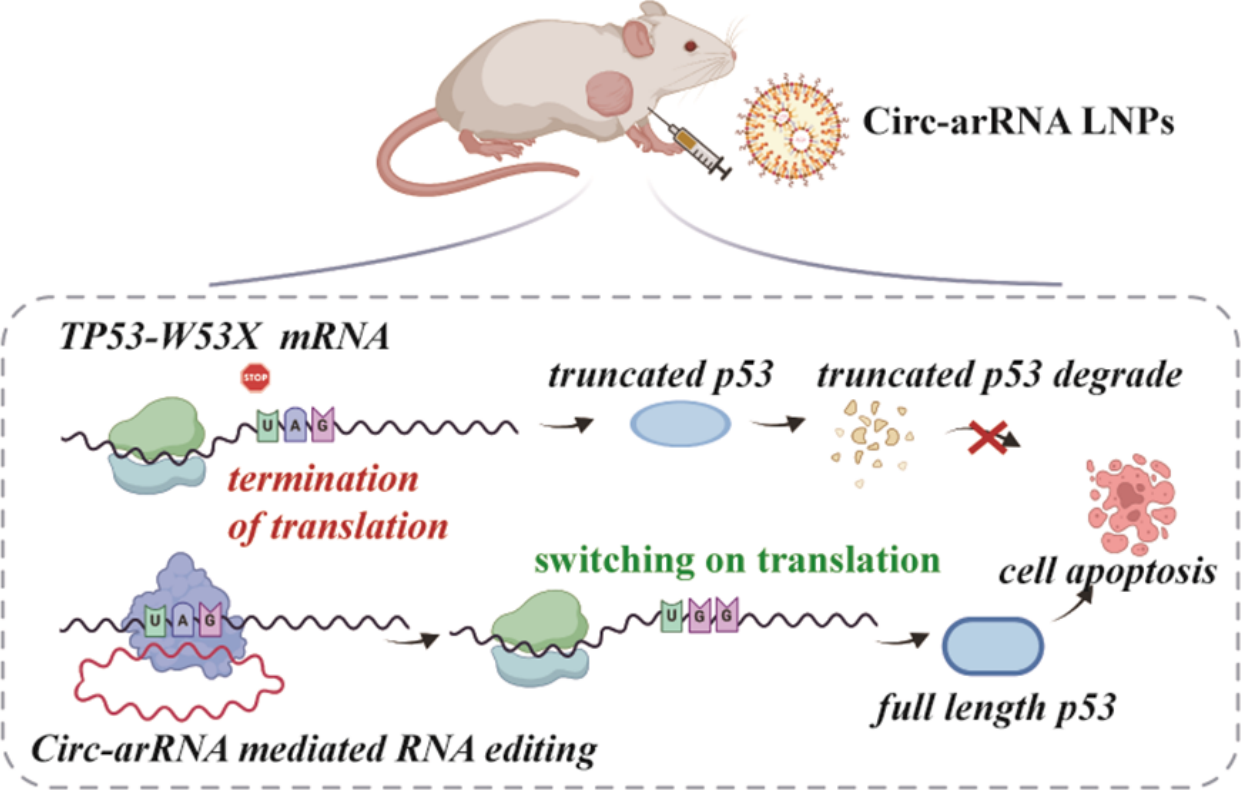
Circ-arRNA介导RNA编辑示意图[14]
德国美因茨分子生物研究所Edward A. Lemke团队使用RNA引导的假尿嘧啶合成酶(DKC1)构建了一个RNA修饰细胞器,实现mRNA选择性Ψ修饰。相比线性gRNA,环状gRNA显著增强了mRNA假尿嘧啶修饰水平,并通过Ψ修饰靶向抑制终止密码子,为从遗传性果糖不耐受等过早终止密码子遗传病提供了新的可能性。
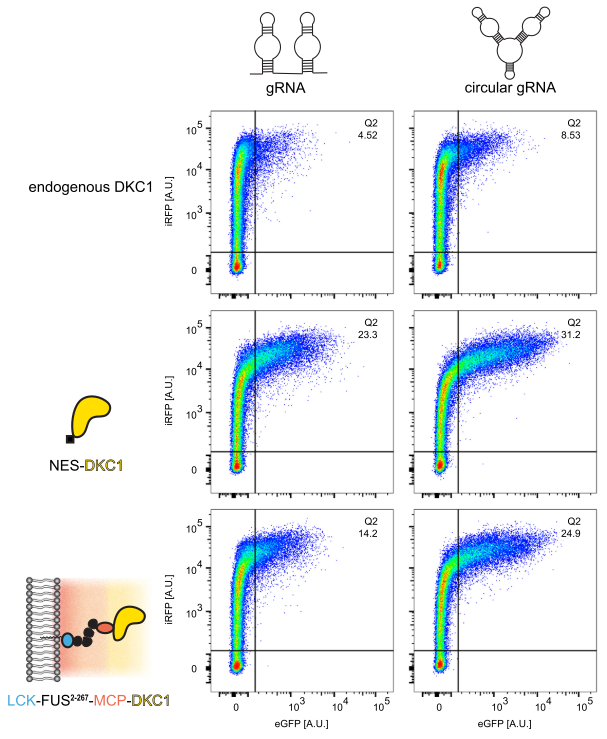
环状和线性gRNA分别介导DKC1在HEK293T细胞中的修饰水平[13]
◆ ◆ ◆ ◆
结语
充满机遇与挑战的未来
◆ ◆ ◆ ◆
环状RNA因其高稳定性、低免疫原性低等优势,为基因编辑工具提供了更稳定的导航、更持久的动力和更安全的保障,直击当前精准基因编辑在递送领域的核心痛点,在风靡全球的基因编辑领域,成为一颗耀眼的新星。
然而,环状RNA在基因编辑中的实际应用仍面临一些关键挑战。
规模制备瓶颈
编辑工具酶分子量较大(尤其是最常用的Cas9),编码的circRNA序列特别长,而引导RNA序列则通常特别短。这类超长和超短序列circRNA合成难度较大,容易导致环化效率降低、副产物增加等问题,亟需开发高效、稳定的规模化制备工艺。
核心合成工艺突破底层技术
吉赛生物凭借两大核心环化专利与深厚合成经验,突破了circRNA体外合成序列长度限制,实现了超长、超短序列的高效精准合成,覆盖从编码编辑器到引导RNA的全范围应用,进一步拓宽circRNA在基因编辑中的应用边界。
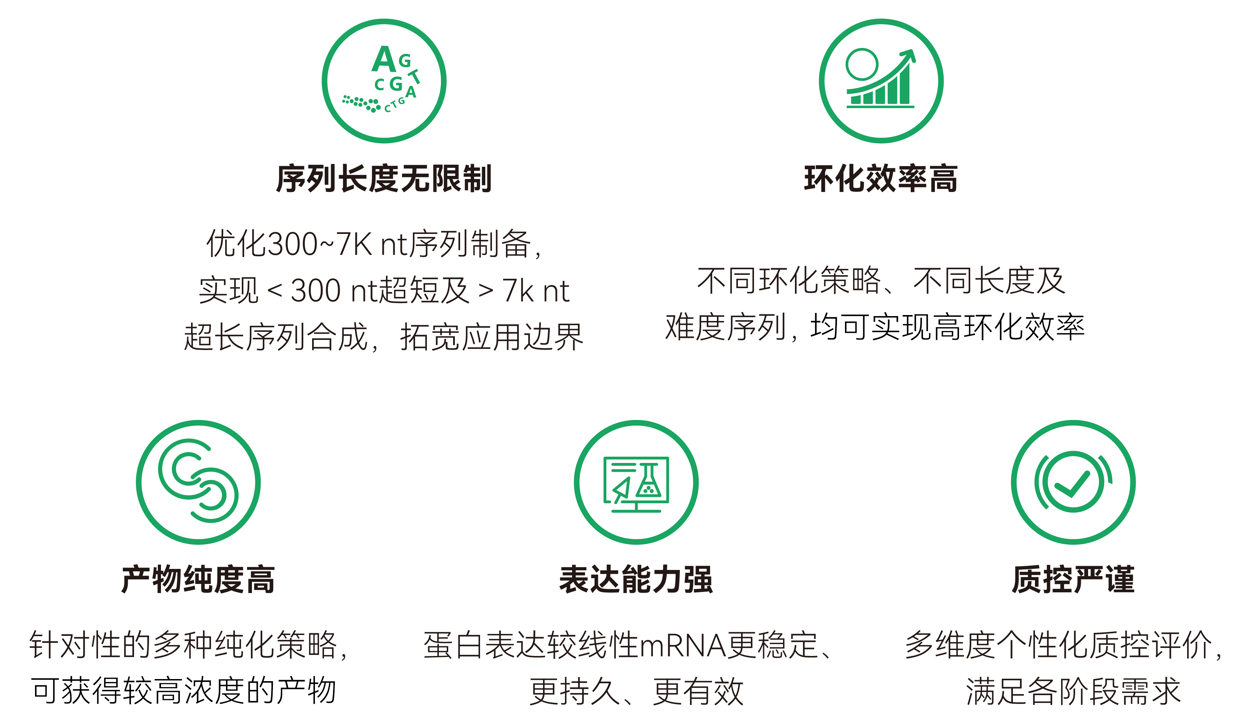
核心酶原料实现降本增效
吉赛生物依托自主研发和生产体系,提供一系列circRNA体外合成的高性能核心工具酶,有助于提升circRNA合成效率,进一步降低基因编辑药物的生产成本,为药物开发与产业化提供稳定原料支撑。
体内验证数据有限
环状RNA在基因编辑的应用仍处于早期阶段,其体内递送和给药策略仍需进一步优化,在体内的编辑性能和安全性仍需更系统的评估。
吉赛生物解决方案
circRNA基因编辑药物开发CRDMO服务
吉赛生物已构建覆盖circRNA药物全链条的技术平台与服务体系——从靶点发现到规模生产,涵盖序列设计、成药性评价、工艺开发、质量研究至GMP生产,形成完整闭环,为circRNA基因编辑疗法开发提供全程护航。
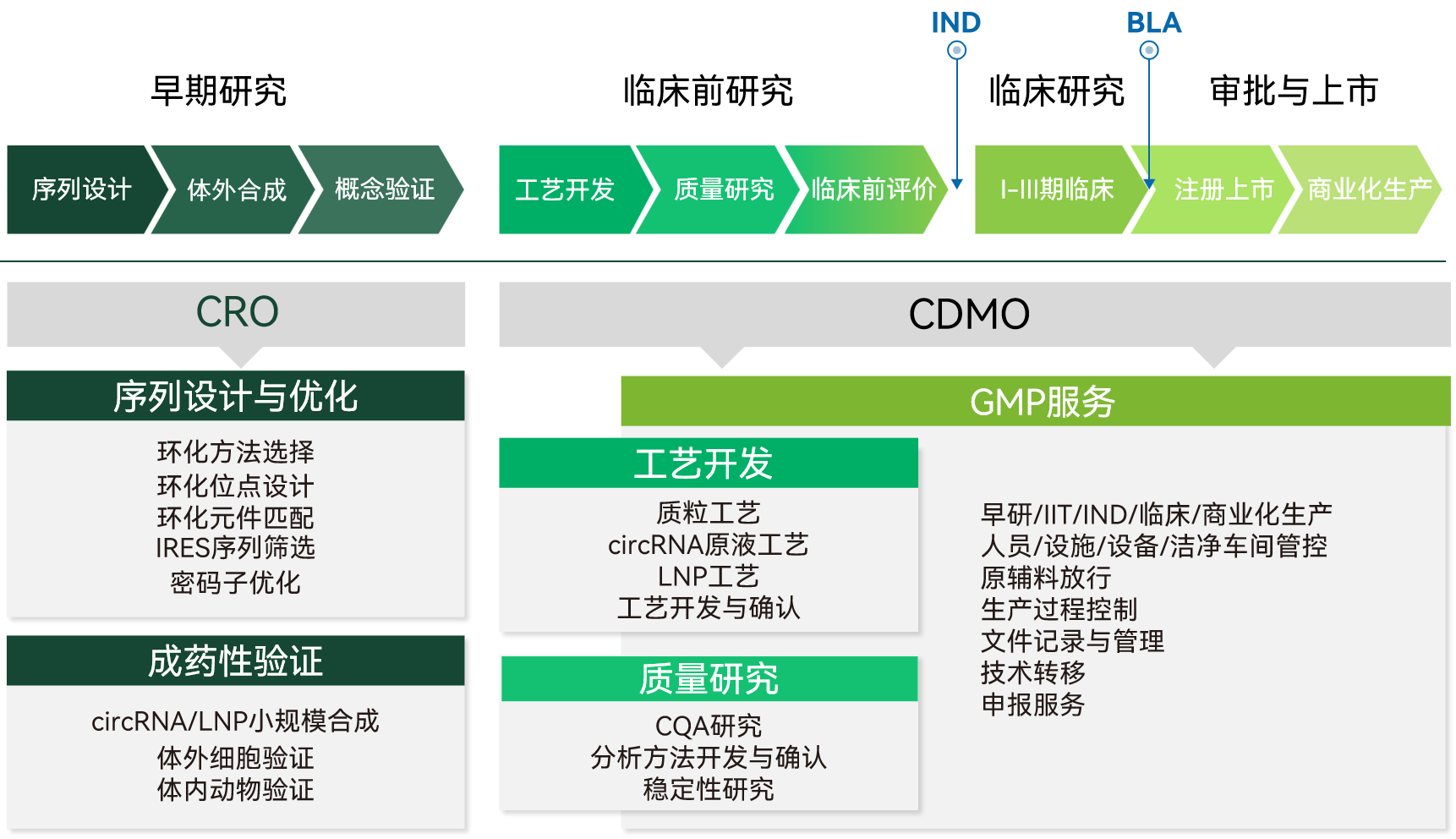
随着技术进步和平台的成熟,这些挑战正逐步被克服。环状RNA与基因编辑强强联合,不仅是一项技术的革新,更是一个治疗新时代的曙光。在这个闭环世界里,蕴含着治愈疾病的无限可能!
参考文献