- ·
单细胞全转录组测序
- 产品介绍
- 案例解析
服务介绍
circRNA和lncRNA常表现出高度的细胞或组织特异性,需要在单细胞分辨率下进行分析,但市面上大多数单细胞测序平台主要分析有poly(A)尾的mRNA。吉赛生物单细胞全转录组测序服务,突破性实现单细胞分辨率的全转录组分析!帮助广大科研工作者解决circRNA和lncRNA等不含poly(A)转录本的细胞异质性分析难题,解锁每一个细胞中完整的RNA世界!
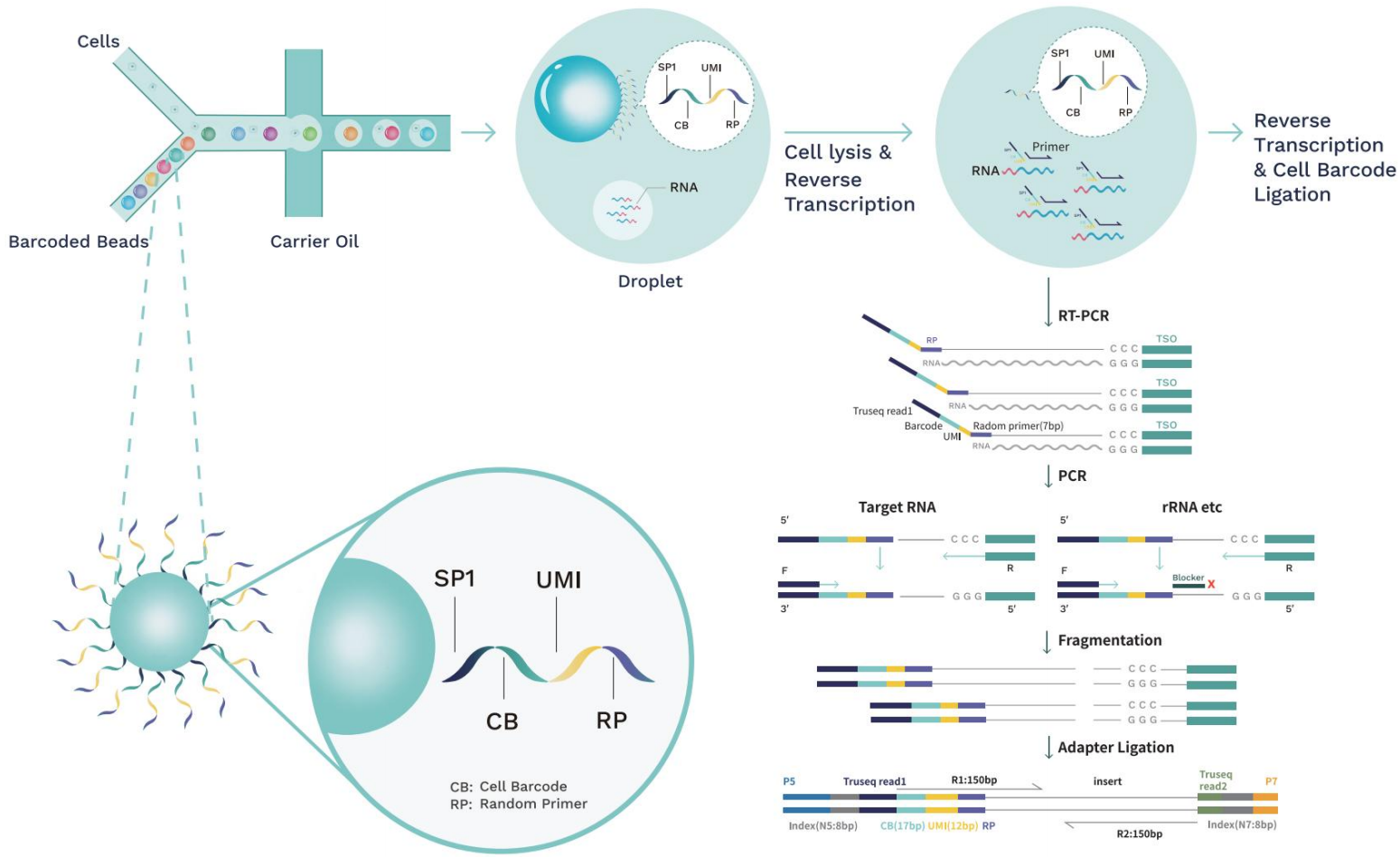
单细胞全转录组测序技术原理。
服务优势
① 突破RNA类型限制,实现无偏差检测:不仅可在单细胞分别率下高效检测mRNA,更覆盖各类非poly(A)转录本,包括circRNA、lncRNA和微生物(如病毒、原核生物)来源的non-poly(A)基因,真实还原样本转录组的全貌,有利于更深入研究circRNA、lncRNA调控网络、挖掘关键的circRNA、lncRNA生物标志物和治疗靶点、精准区分细胞亚型、捕捉实验样本的细微动态变化;
② 覆盖全序列,释放分析潜能:随机引物捕获,打破3’或5’端转录组的局限,实现全序列覆盖,确保每一条测序读段均有效用于分析,为可变剪接分析、突变检测、新转录本发现等研究提供更全面、可靠的数据支撑。
③ 特色生信分析,全面分析转录组:除了常规的单细胞测序分析(如细胞聚类分析、细胞类型鉴定、Marker基因分析、功能注释与分析、组间差异分析等),还额外增加针对性的circRNA、lncRNA表达和功能分析,以及变异、可变剪接等分析,提供多维度数据。
④ 单细胞分辨率,准确描绘基因表达谱:实现单细胞水平基因突变或全转录组差异表达检测,更准确鉴定驱动差异的细胞来源,探索差异细胞微环境特征,在单细胞层面分析细胞功能改变。
(1)研究非编码RNA
论文标题:Assessment of the cardiac noncoding transcriptome by single-cell RNA sequencing identifies FIXER, a conserved profibrogenic long noncoding RNA
发表期刊:Circulation
lncRNA在许多心血管疾病中具有关键功能,它们比编码基因更具有细胞特异性。研究使用单细胞全转录组测序技术对梗死后非心肌细胞中的lncRNA进行了评估,基于lncRNA的表达从心肌成纤维细胞、肌成纤维细胞和心外膜细胞鉴定到7种细胞亚群,再通过细胞亚群表达的mRNA富集的功能模块和文献报道,将这些亚群注释为抑制细胞增殖、细胞活化、血管分化、DNA 修复、有丝分裂、细胞分化等功能相关细胞亚型。研究证明除了传统的mRNA表达模式外,也可以通过lncRNA表达水平识别出哺乳动物心脏中的各种细胞类型,为lncRNA的深入研究开拓了新的思路。[1]
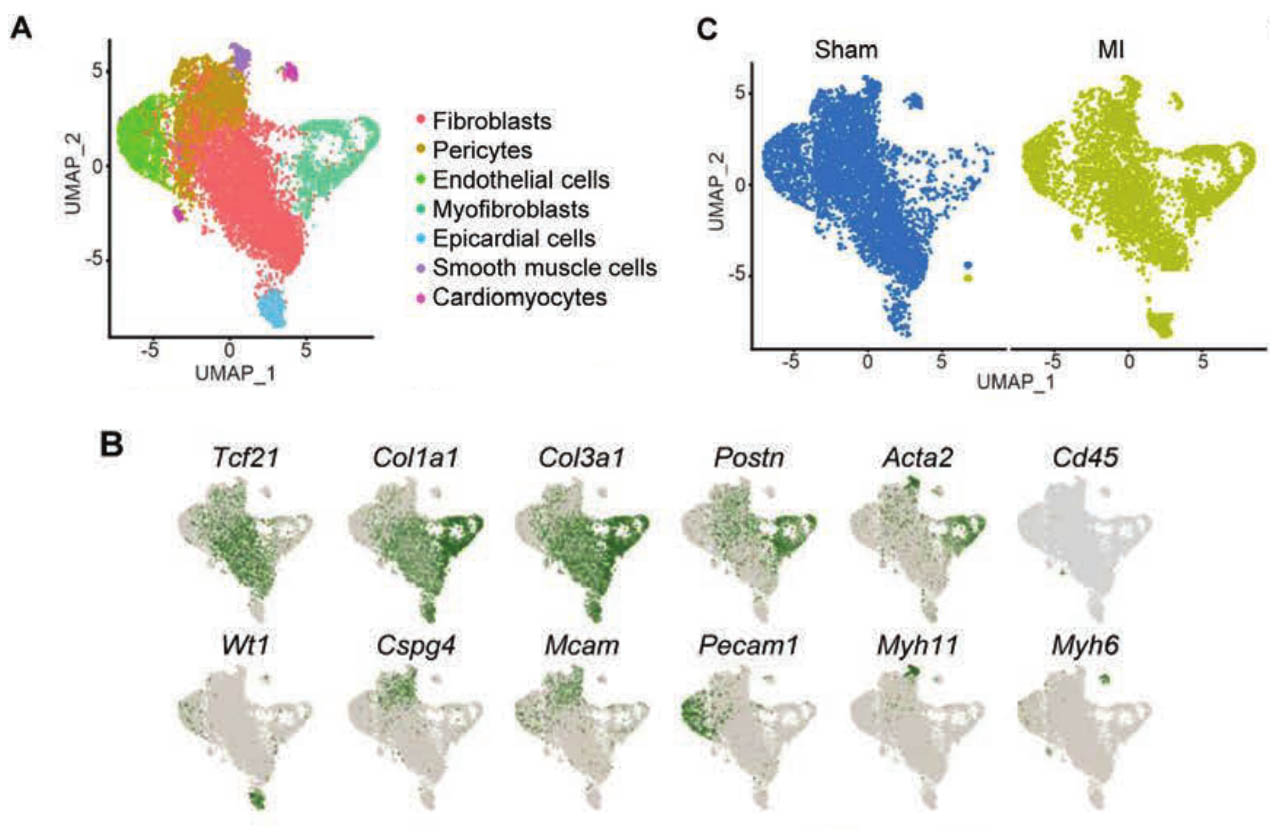
通过单细胞RNA测序确定相关的心肌细胞类型的lncRNA表达谱。A:完全基于lncRNA的表达的非心肌细胞UMAP。B:UMAP图显示每个簇的细胞类型特异性标记的表达。C:UMAP表明假手术和梗死心脏中的细胞簇。
(2)分析可变剪接
论文标题:Splicing diversity enhances the molecular classification of pituitary neuroendocrine tumors
发表期刊:Nat Commun
研究通过联合Bulk-seq和单细胞全转录组测序,全面研究垂体神经内分泌肿瘤(PitNET)表达谱中的可变剪接(AS)失调,揭示了单细胞分辨率下的剪接异质性,以及不同肿瘤细胞类型的剪接失调,还有效地区分了沉默的促肾上腺皮质激素亚型,并定义了一种与更差的临床表现和ESRP1表达变化驱动剪接异常有关的独特TPIT谱系亚型。总之,研究表征了PitNET中亚型特异性AS概况,增强了对PitNET亚型的理解。[2]
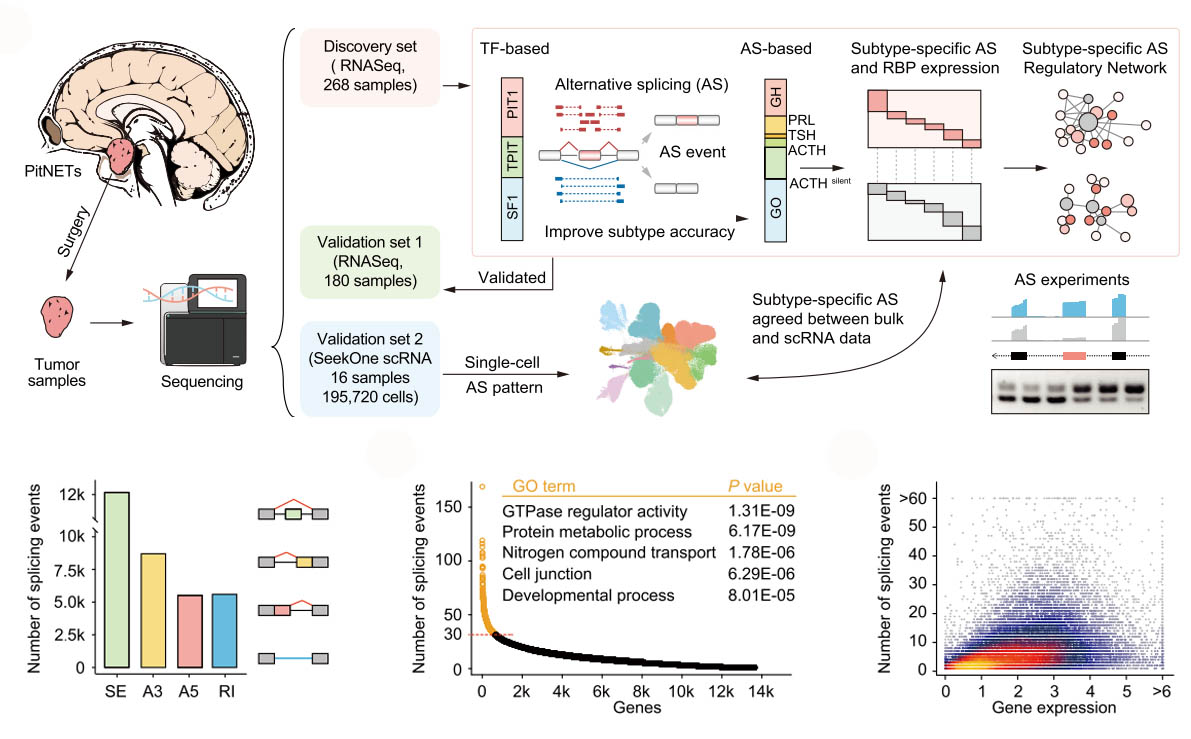
单细胞全转录组测序展现PitNet的剪接多样性。
(3)探索细胞异质性和状态变化
论文标题:Single-cell nascent transcription reveals sparse genome usage and plasticity
发表期刊:Cell
研究利用生物素联合5-EU对新生RNA进行标记,再结合单细胞全转录组技术,基于随机引物无偏好地捕获编码与非编码RNA的优势,以极高的灵敏度和全基因组覆盖范围捕获新生和成熟转录组,呈现了mRNA和基因间非编码RNA 的不同动力学特征,提供了一个独特且全面的单细胞转录动态和异质性的视图。[3]
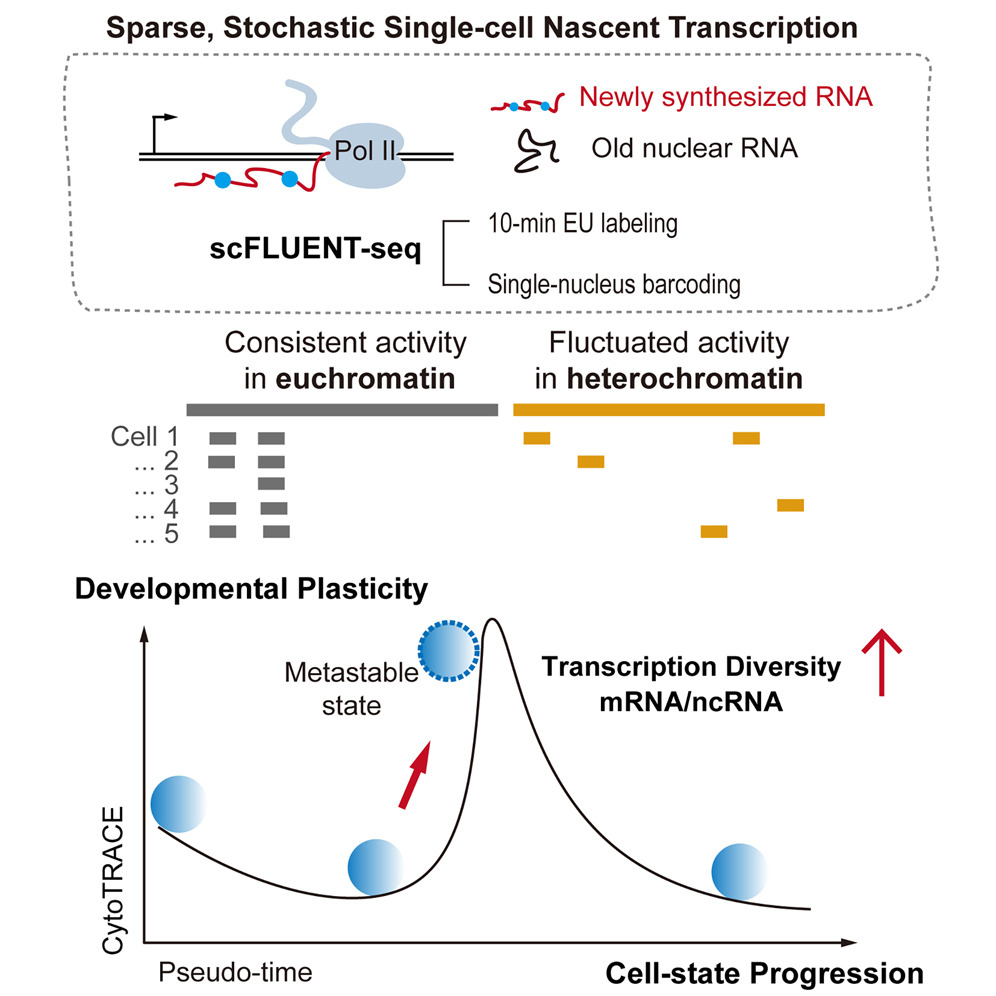
单细胞全转录组测序方案。
(4)研究癌细胞基因突变
论文标题:Spatially restricted drivers and transitional cell populations cooperate with the microenvironment in untreated and chemo-resistant pancreatic cancer
发表期刊:Nat Genet
研究使用单细胞/核转录组(Sc/SnRNA-seq)、空间转录组学、细胞成像、Bulk RNA-seq、WES、蛋白组、磷酸化修饰组等多组学技术,分析31例胰腺导管腺癌(PDAC)患者的83个样本,揭示了胰腺癌发生过程中,从正常细胞到癌变前细胞,从癌变前细胞向胰腺癌细胞转变的细节信息。研究将突变映射到单个细胞上,通过比较肿瘤细胞的每个亚群与给定的KRAS突变的基因表达谱来检测KRAS突变的影响,结果表明在同一患者中携带不同KRAS驱动突变的两个不同的克隆具有不同的基因表达谱。[4]
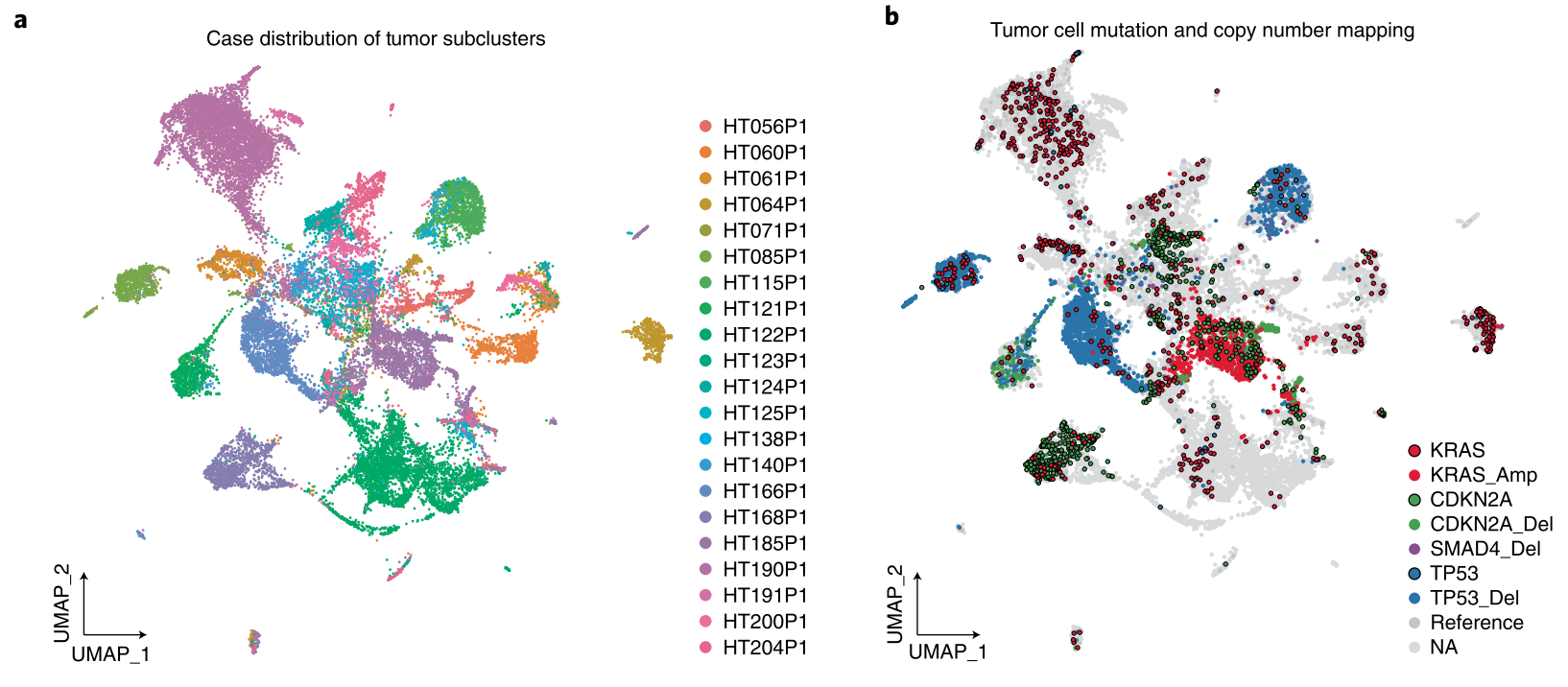
PDAC中的KRAS突变信号。a:用病例ID标记的肿瘤细胞簇;b:用基因组改变(突变和拷贝数变化)标记肿瘤细胞。参考资料
[1]Aghagolzadeh P, et al. Assessment of the Cardiac Noncoding Transcriptome by Single-Cell RNA Sequencing Identifies FIXER, a Conserved Profibrogenic Long Noncoding RNA. Circulation. 2023;148(9):778-797.
[2]Huang Y, et al. Splicing diversity enhances the molecular classification of pituitary neuroendocrine tumors. Nat Commun. 2025;16(1):1552.
[3]Ma S, et al. Single-cell nascent transcription reveals sparse genome usage and plasticity. Cell. 2025:S0092-8674(25)01034-7.
[4]Cui Zhou D, et al. Spatially restricted drivers and transitional cell populations cooperate with the microenvironment in untreated and chemo-resistant pancreatic cancer. Nat Genet. 2022;54(9):1390-1405.
填写需求描述给我们
工具快速咨询
400-8989-400
geneseed@geneseed.com.cn

 购物车
购物车




 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn