
- 首页
- >
- GENESEED
- >
王学仁/单革/陈亮团队系统鉴定EIciRNA并揭示其特征及生理功能

由核基因组编码的环状RNA (circRNAs)是一类由剪接相关机制产生的共价封闭单链。其中外显子环状RNA (EcircRNAs)和外显子-内含子环状RNA (EIciRNAs)是通过反剪接产生的,这是一种非规范选择性剪接(AS)。在反向剪接中,外显子的3 '端连接到外显子的上游5 '端,形成反向剪接位点(BSJ)并产生环状RNA。EIciRNAs保留内含子,而EcircRNAs只包含外显子序列,因此两者在序列组成上存在差异。
EIciRNA为中国科学技术大学单革教授团队首次发现,但由于缺乏可靠的生物信息学工具,EIciRNA 的总体特征及其调控生理病理的功能和机理仍未得到全面的研究。与研究得较为充分的线性转录本中的内含子保留(retained introns in linear RNAs, LIR)相比,环形RNA内含子保留 (retained introns of circRNAs,CIR) 的系统性分析尤其缺乏。
近日,中国科学技术大学陈亮研究员、单革教授联合华中科技大学同济医院王学仁教授科研团队,在Genome Research期刊在线发表题为 Systematic identification and characterization of exon-intron circRNAs 的研究论文。研究团队通过开发一种名为FEICP(Finding exon-intron circRNAs from paired-end RNA sequencing)的计算分析方法,从人类组织、细胞的高通量测序数据(High throughput sequencing,HTS)中鉴定到大量EIciRNA,结合生物信息学分析和实验,描述了EIciRNA的独特序列特征、表达调控机制与生物学功能。

FEICP计算流程可以有效地从HTS数据中识别EIciRNA
研究团队运用开发的FEICP计算流程,输入双端(paired-end)RNA-seq高通量二代测序数据,并从数据中可靠地检测出EIciRNA;通过与已发表的三代纳米孔测序 (Nanopore long-read sequencing) 数据进行比较,评估了FEICP对EIciRNA鉴定的性能,发现FEICP具有灵敏度较高、假阳性较低的优势。
EIciRNA与EIciRNA的特征比较
研究通过FEICP对EIciRNA的序列、细胞定位、表达等特征进行了系统分析,发现与EcircRNA相比,EIciRNA具有序列普遍更长、主要定位于细胞核、侧翼内含子更短,具有更少的Alu元件等特征。
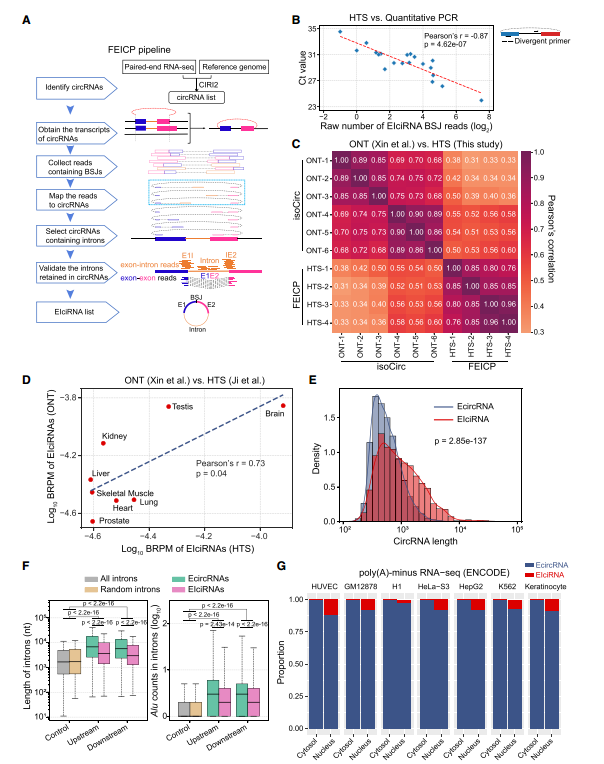
图1. FEICP计算流程和EIciRNA的全基因组分析
EIciRNAs的表达具有高度的组织特异性,并受到RBP的精细调控
研究团队使用FEICP分析了102组人类细胞系和组织的RNA-seq数据,通过采样、拟合分析,推断人基因组中约有16%的内含子序列可被保留于circRNA中,而约有37%的基因可以产生EIciRNA;通过比较不同组织类型中EIciRNA的表达,发现EIciRNA富集于大脑,与mRNA, lncRNA, circRNA相比,有更强的组织特异性表达。表达相关性分析表明,RBPs复杂地调节EIciRNA的表达,并且大多数EIciRNA与RBPs呈负相关。
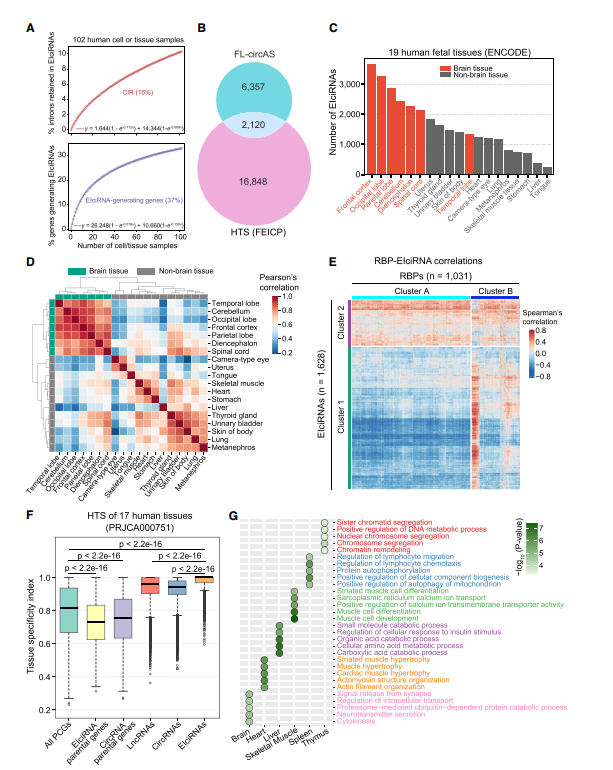
图2. 人类转录组中EIciRNAs的鉴定和分析
产生EIciRNAs的基因转录更为活跃
研究团队对EIciRNA的亲本基因表达进行了系统分析,结果发现,基因表达水平的上调,能产生更多EIciRNA,且更多的内含子被保留于其中;这与线性RNA中的内含子保留呈相反的趋势。研究综合分析了已发表的RNA-seq, ChIP-seq, TT-seq多种高通量测序数据, 结果发现,与EcircRNA相比,EIciRNA亲本基因启动子区域含有更多组蛋白修饰位点和更开放的染色质,EIciRNA的基因转录更为活跃、表达水平普遍更高。
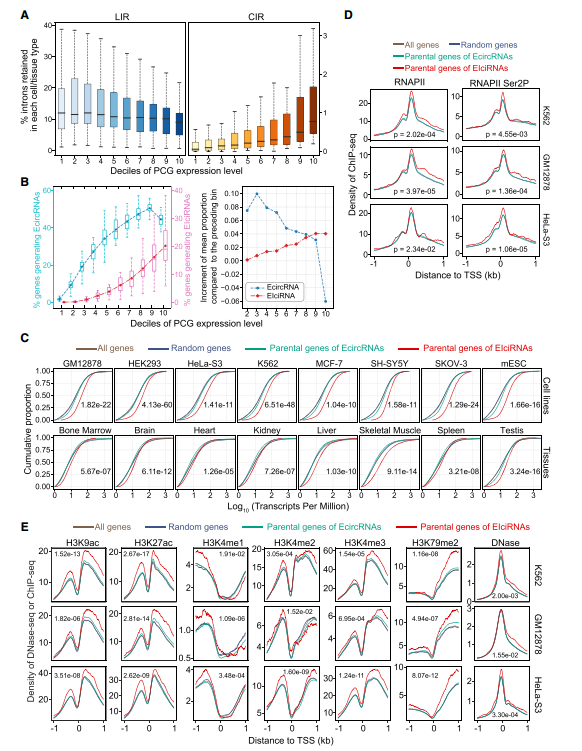
图3. EIciRNAs亲本基因转录活跃
CIRs不同于LIRs和其他内含子
研究团队对比CIRs和LIRs,发现两种内含子重叠区域较少,说明CIR是一类独特的内含子。研究基于1309个内含子序列特征,构建了能有效区分CIR, LIR及EcircRNA中被剪接掉的内含子 (non-circRNA-retained intron, NCI) 三类内含子的三层神经网络。训练该神经网络后得到的分析结果表明,与NCIs相比,CIRs内含子5’端和3’端的序列保守性更强,RBP结合位点更多,内含子两侧外显子长度更短,可翻译性更低;与LIRs相比,CIR序列的GC 含量更低,序列长度更长,更倾向于形成局部二级结构,内含子5’端序列保守性更强,更倾向于靠近基因的5’端。
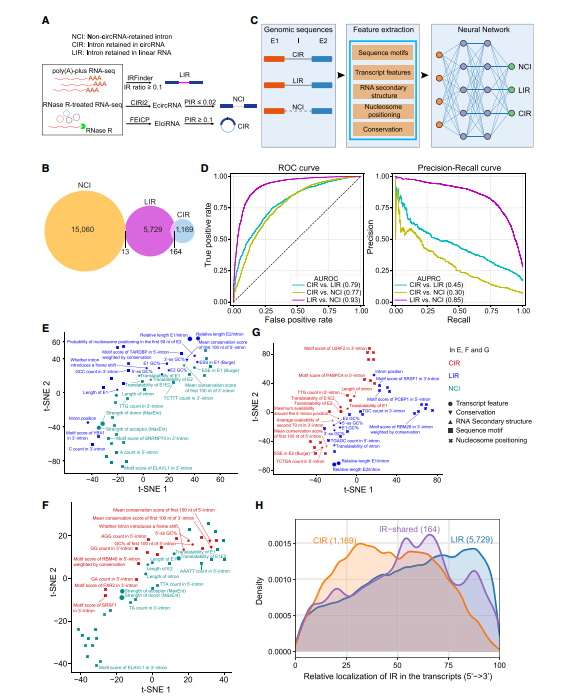
图4. CIR的特征与LIR和其他内含子的比较
全基因组CRISPR-Cas9筛选调节CIRs的基因鉴定SRSF1
研究团队通过全基因组CRISPR筛选,并构建内含子分裂GFP报告基因,结合分子细胞实验研究与计算分析,发现剪接因子SRSF1可与内含子结合,抑制大部分EIciRNA的生成。

图5. 全基因组CRISPR筛选鉴定EIciRNA生物发生的调节因子
SRSF1调节EIciRNA的生物发生
研究团队通过iCLIP-seq及对SRSF1敲低细胞株进行GRO-seq等研究,结果表明SRSF1可以通过与亲本基因内含子中的特定基序结合抑制CIR产生,从而抑制部分EIciRNA的生成。SRSF1可能通过不同的机制,对CIR与LIR进行相互独立的调控。
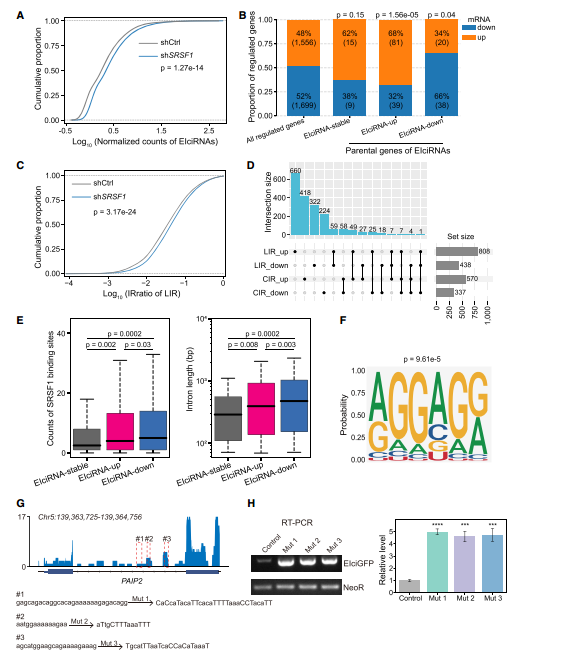
图6. SRSF1与CIR结合以抑制EIciRNA的生物发生
CIRs和EIciRNAs的产生对神经元分化有调控作用
研究团队利用SH-SY5Y细胞建立神经元分化模型,研究分化过程中EIciRNA的表达与功能。结果发现,随着分化,SH-SY5Y细胞产生的EIciRNA逐渐增加,而大部分剪切相关因子 (如SRSF1) 的表达水平逐步降低。研究通过时序聚类分析得到在分化过程中表达水平逐渐上调的EIciRNA,并对其亲本基因进行功能富集分析,结果发现这些基因与神经活性、细胞极性相关,且在分化早期,基因表达水平也随着分化增加。这些结果表明,在神经分化早期,EIciRNA可能通过促进亲本基因的表达进而调控分化。文中以EIciLIMK1为例作为验证,其在分化中的表达受SRSF1调控,而敲低EIciLIMK1使其亲本基因LIMK1的转录水平下降,进而导致丝切蛋白Cofilin的磷酸化水平及 F-actin表达的水平降低。
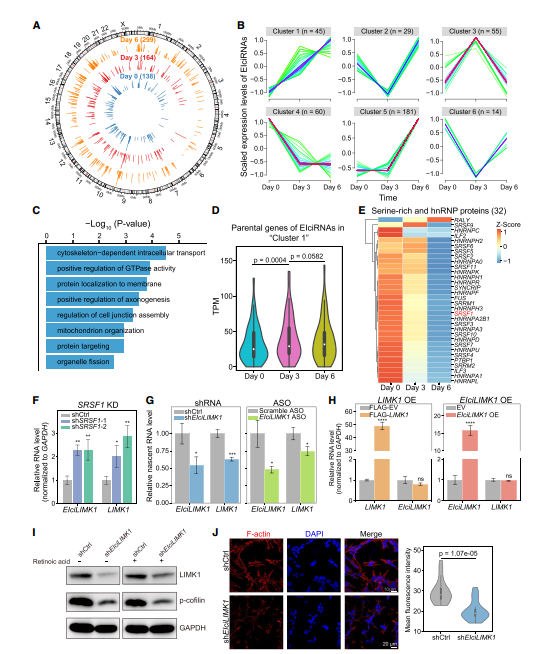
图7. EIciRNA在神经元分化中的功能作用
总结
研究团队开发了FEICP这种计算框架,可以从短读子的双端RNA-seq数据中有效检测CIR。FEICP能系统地鉴定组织和细胞HTS数据中的EIciRNA,并揭示了CIRs和EIciRNA的多重特征。研究还分析了EIciRNA的表达模式和功能作用的特征:SRSF1通过与CIRs结合抑制部分EIciRNA的生物发生;EIciRNA和对EIciRNA生物发生的调控在神经元分化中起着关键作用。本项研究不但提供了EIciRNA鉴定和表征的方法,还丰富了EIciRNA的序列、生物学功能及表达调控的研究。
运用二代测序研究EIciRNA需配合可靠的检测计算流程和生物信息学分析工具,使EIciRNA的一般特征和生物学意义的研究较少。但除二代测序以外,文中也提到基于ONT(Oxford Nanopore Technologies)平台的三代测序技术是circRNAs全长测序和鉴定分析EIciRNA的强大工具,并将已发表的ONT测序数据作为参考,对比FEICP算法的有效性。新兴的Nanopore circRNA全长测序技术是利用随机引物对富集后的circRNA进行滚环反转录扩增,采用纳米孔测序技术对circRNA的全长序列进行直接测序,并使用特定算法,实现对长测序片段中的circRNA序列进行识别和全长重构。
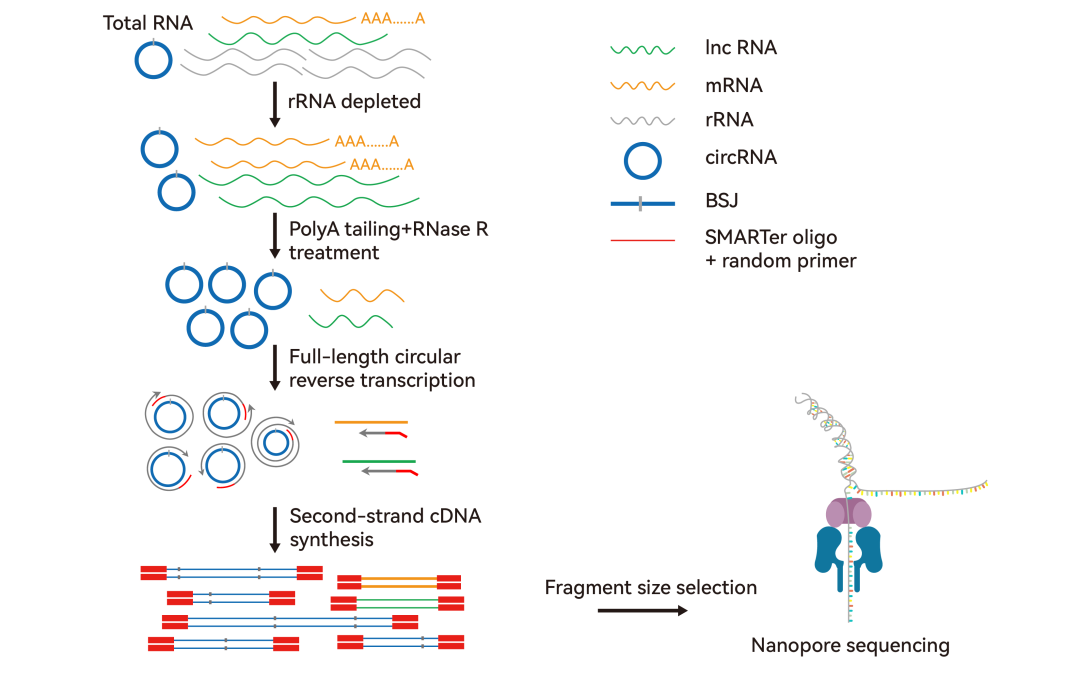
circRNA全长纳米孔测序技术路线
纳米孔测序技术在检测circRNA上有极大优势:
1. 更强的检出率:相比二代测序,纳米孔测序可以将circRNA reads检测效率提高20倍以上。
2. 更高的灵敏度:可识别低丰度的circRNA,能够更敏感地捕获到非经典circRNA(包括EIciRNA)。
3. 更多更准确的应用领域:
1)准确识别可变剪切事件,无需拼接,一键生成;
2)直接识别癌症等重大疾病发生发展的重要生物标志物一一融合环状RNA(f-circRNA);
3)能够更敏感的识别研究热点一一线粒体环状RNA,确保您的研究不会落空。
吉赛生物已建立完善的Nanopore三代测序平台,可提供专业的Nanopore circRNA全长测序及生信分析等科研服务,助力科研人员更精准、更全面、更快捷地开展circRNA相关研究!

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn