
- 首页
- >
- GENESEED
- >
LNP凭什么能成为RNA的护卫队?
LNP的发展助推RNA成为疫苗顶流
RNA在体内能发挥多种强大功能,如翻译蛋白、干扰基因表达、介导蛋白互作、调节基因转录或翻译等。近年来,研究者们热衷于针对肿瘤、传染病等各种疾病的开发预防和治疗的RNA药物,RNA作为新兴的治疗药物拥有广阔而远大的发展前景。
RNA具有表达范围广、安全性高、规模生产容易、成本低等独特的优点。然而,RNA就如才智双全但略显文弱的宰相,将RNA送向临床面临不少挑战:
①(孤身一人的RNA会被素未谋面的禁军拒之门外)RNA链带负电荷,而细胞膜表面也带负电荷,静电排斥使RNA分子难以穿过细胞膜进入细胞内。
②(独自旅行的RNA会被各路绿林草莽伤害)RNA分子,特别是线性mRNA分子极容易降解,体内多种酶都能将其迅速降解。
③(冒然闯入的RNA甚至会被军队误认为间谍)mRNA分子有较强的免疫原性,容易被识别为外源核酸激活免疫反应。
被称为mRNA2.0的环状RNA,因独特的闭环结构而稳定性更强,且免疫原性更低,一定程度上强化了RNA在体内的作用,有望替代线性mRNA成为RNA疫苗的主流。但作为药物在体内稳定发挥作用,RNA还需要安全、有效和稳定的递送系统。已有多种mRNA递送材料被开发,包括脂质、类脂质材料、聚合物和蛋白质衍生物等类型。其中装载RNA的脂质纳米颗粒(Lipid nanoparticle,LNP)是目前被认为最有效和首选的RNA纳米载体。LNP已成功进入临床用于RNA的递送,如LNP- mRNA疫苗已用于临床治疗COVID-19,这标志着RNA治疗的一个里程碑。
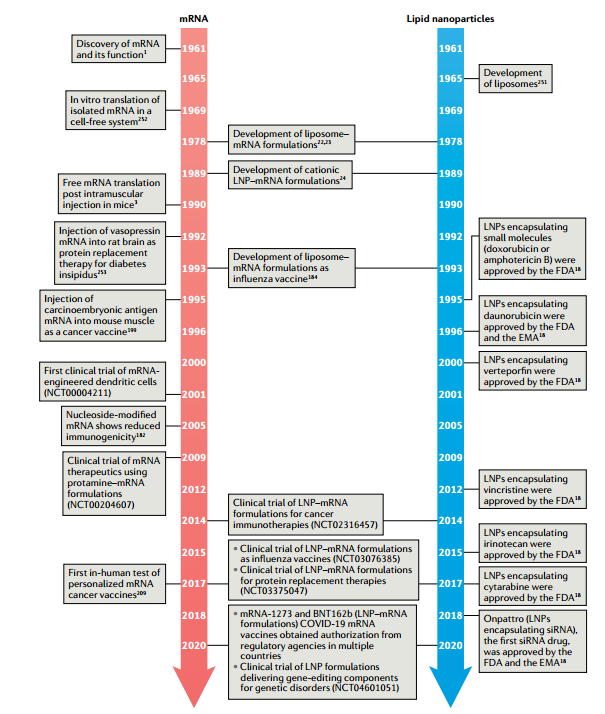
mRNA和脂质纳米颗粒发展的一些关键里程碑时间表[1]
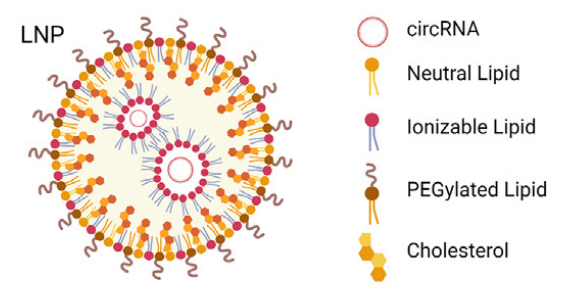
LNP-RNA的成分和结构
除了负载于内核中的RNA以外,LNPs通常包括四种成分:可电离脂质(Ionizable lipid)、胆固醇(Cholesterol)、辅助磷脂(Phospholipid)和聚乙二醇化脂质(PEG-lipid),它们共同包裹并保护内核的RNA。
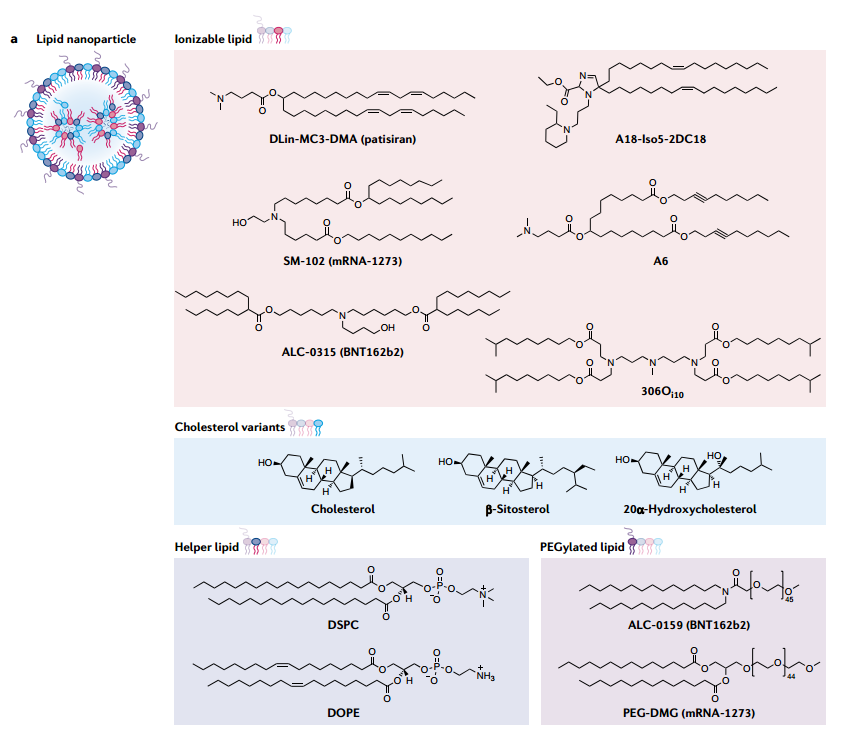
LNPs结构示意图[2]
可电离脂质(Ionizable lipid)——RNA的近身侍卫
可电离阳离子脂质在LNP中占总脂质的30-50%,分为三部分结构:胺基头部基团、疏水性尾部基团和内部连接片段。可电离阳离子脂质是通过静电相互作用启动自组装的第一步,也是LNP配方中的关键成分,RNA递送和转染效率的决定性因素。
可电离脂类在低pH值下可电离,带正电荷,但在生理pH值保持中性。利用这种pH敏感性有利于RNA的体内递送。根据阳离子脂质头部基团的胺基数量,可分为单胺基或多胺基脂质。此外,通过调整脂质尾部结构,如改变尾部数量、设计线性或分支结构以及引入不饱和或可生物降解的键,可增强效力或赋予特定功能。其中,最著名的DLin-MC3-DMA(MC3)、SM-102和ALC-0315三种阳离子脂质均是单胺基脂质,也是经FDA批准的唯三可用于RNA递送的可电离阳离子脂质(吉赛生物可提供这三种LNP配方的包封服务)。
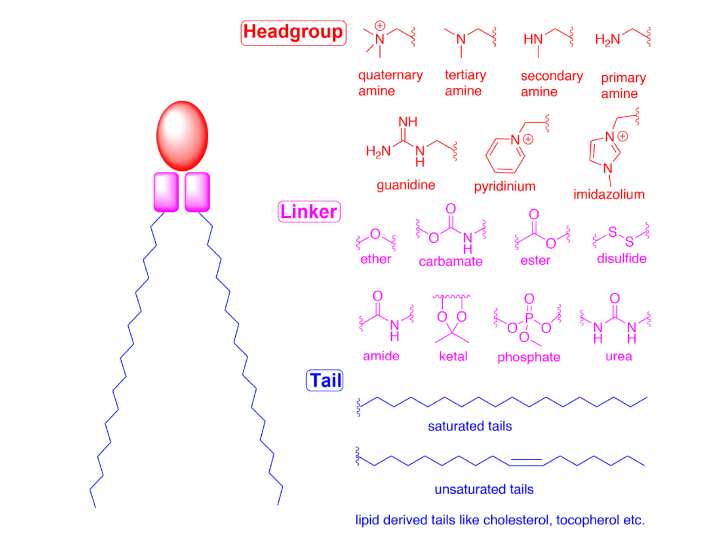
可电离阳离子脂质结构(头组、连接器和尾)示意图[3]
胆固醇(Cholesterol)——RNA的护卫骑兵
LNP配方中,胆固醇通常占总脂质的20%-50%,主要存在于LNP的外壳,有较强的膜融合性,有助于增加LNPs的稳定性,并帮助细胞膜融合。对胆固醇结构的修饰和优化,可以提高LNPs的递送效率并赋予LNPs特定的功能。
磷脂(Phospholipid)——RNA的马车
磷脂作为结构脂,占LNPs的10-20%,辅助LNPs自组装和防止内涵体逃逸。辅助磷脂一般为的饱和中性磷脂,能自发组织成脂质双层,有利于提高LNPs的相变温度,从而维持LNPs膜的稳定性。与细胞膜一样,磷脂位于LNPs的外围,或在LNPs内核的外围。
PEG化脂质(PEG-lipid)——RNA的护卫枪兵
PEG化脂质是控制LNPs半衰期和细胞摄取的重要组分。由于PEG链的亲水性且较大的体积,在LNP组装过程中留在LNPs的表面,能改善LNPs的亲水性。PEG链为LNPs提供了外聚合层,以阻碍血清蛋白和单核吞噬细胞的吸附,延长LNPs在体内的循环时间,同时防止LNPs在血液中的积累和聚集。PEG化脂质另一个潜在作用是能令LNPs的表面功能化,改造的PEG化脂质使LNPs与配体或生物大分子的生物偶联,能赋予LNPs的靶向性功能,改变其药代动力学和药效学等。但过量的PEG化脂质会对LNPs的细胞摄取和转染不利,PEG链的长度也是决定LNPs降解和起效速率的重要因素。
LNPs的形成原理
LNPs是在微流控混合平台中,通过混合有机相与水相沉淀脂质而配制的。通常脂类溶解在乙醇中,RNA溶解在pH 4的柠檬酸盐或醋酸盐缓冲液中,混合两种溶液使可电离脂质质子化。质子化的脂质和阴离子RNA之间产生静电吸引。同时,由于脂质水溶性差而产生的疏水作用,驱动LNPs自发组装,并把RNA包裹其中。然后对LNPs进行透析或过滤,去除非水溶剂,使溶液达到生理pH。
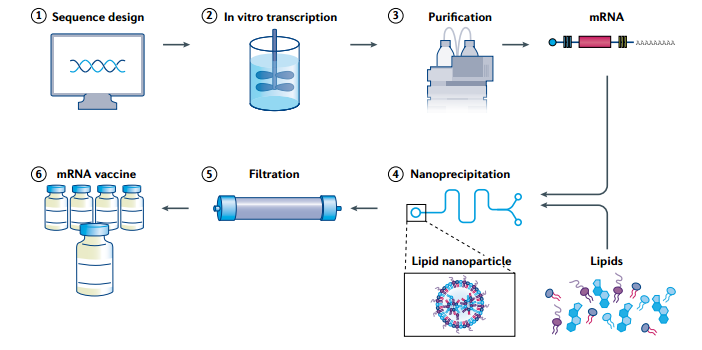
IVT mRNA经过LNP包封配制成疫苗流程示意图[2]
LNPs的递送机制
LNP包封保护的RNA免受核酸酶切,提高RNA分子的稳定性。LNPs中可电离脂质和PEG化脂质在生理pH下呈中性,减少了与血清蛋白的非特异性相互作用。PEG链解离后,LNPs与血清中的ApoE形成脂质复合物,将其转运到表达低密度脂蛋白受体 (LDLR) 的细胞膜上。
LNP的中性脂质结构使其与细胞阴离子膜静电相互作用较少,有较好的生物相容性。LDLR介导LNPs胞吞,LNPs进入细胞。随着细胞内含水解酶的溶酶体分解外源大分子,pH降低形成偏酸环境。酸性环境下,可电离脂质质子化,带正电荷,其磷脂较小的两性离子头部和疏水链尾部形成锥形结构,促进LNPs膜向六方晶相转变,导致其脂质膜的不稳定,促进LNPs内核中RNA的释放。理想的药物载体一旦达到目的,就会迅速从体内清除。因此各种LNPs在可电离的脂质中一般都会加入可生物降解的设计,以促进其进入细胞后迅速降解。
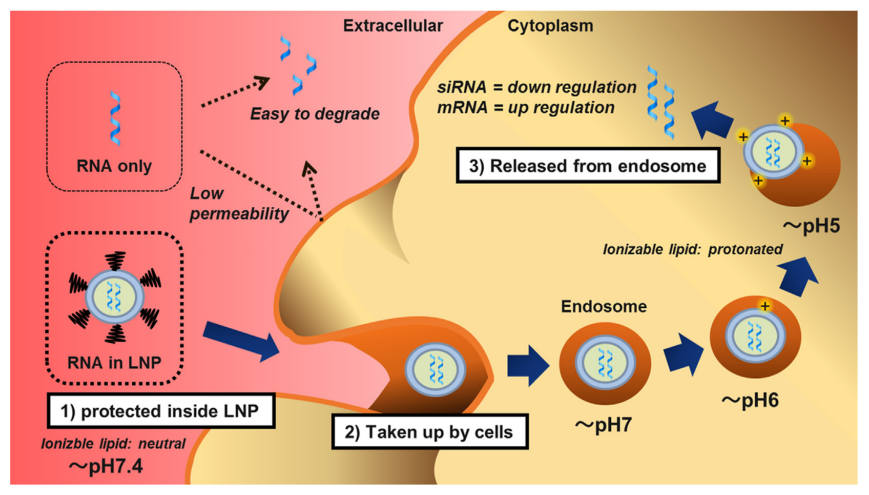
LNPs递送RNA的机制[4]
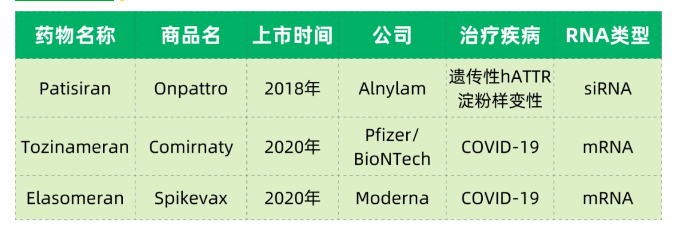
已上市RNA药物的LNP对比
基本信息对比
储存条件对比
研究团队通过全基因组CRISPR筛选,并构建内含子分裂GFP报告基因,结合分子细胞实验研究与计算分析,发现剪接因子SRSF1可与内含子结合,抑制大部分EIciRNA的生成。
LNPs结构对比
三种药物的LNPs都由上述四种典型的脂质类型以相似的摩尔比组成。三者仅是可电离脂质和PEG化脂质的结构有差异,而三种可电离脂质都有叔胺基团。
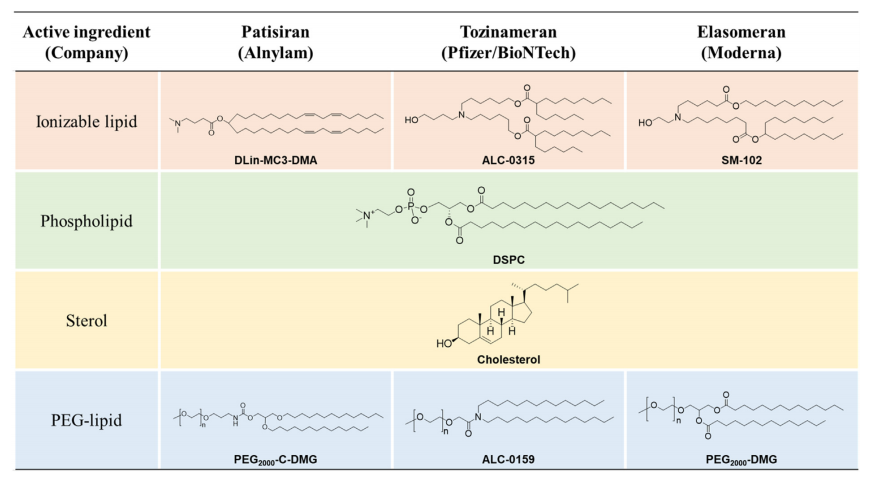
Patisiran,Tozinameran和Elasomeran的LNPs配方组成成分的化学结构[4]
降解效率对比
区别于MC3,ALC-0315和SM-102在脂质尾部有酯键。酯键的水解有助于快速消除和提高耐受性。因此,相比MC3,肌肉注射ALC-0315和SM-102后,能被更快地清除,并改善耐受性。

可电离脂质的生物降解(化学结构中的粉色圆圈表示水解位点)[4]
LNP包封circRNA效果如何?
LNP封装和递送完整对circRNA同样具有很强的兼容性,LNPs为circRNA的递送提供了一个极具前景的平台。大量研究已证明LNP对circRNA递送的有效性。
魏文胜教授团队用LNP包封编码SARS-CoV-2受体结合结构域的circRNA开发预防COVID-19的疫苗,注射小鼠体内能诱发免疫反应并提供有效的保护(Qu et al., 2022)。
王泽峰教授团队对编码猴痘病毒表面蛋白的circRNA进行LNP包封后,注射小鼠体内能产生大量的中和抗体,有效对抗猴痘病毒(Zhou et. al., 2024)。
陈玲玲研究员团队通过尾静脉注射LNP-ds-cRNA到小鼠体内,证明了LNP-环状RNA的安全性,并实现了作为适配体的ds-cRNA对PKP异常激活相关炎性疾病小鼠模型银屑病的干预治疗(Guo et. al., 2024)。
吉赛生物拥有自主知识产权的Ⅰ型内含子自剪切和连接酶法两种成环技术策略,建立了circRNA一站式服务平台,可提供序列设计、基因合成、质粒制备、线性化mRNA、circRNA制备、LNP包封服务,能满足RNA体内研究和疫苗开发需求,为科研工作者节约时间和成本。
吉赛生物可提供三种FDA批准LNP配方的包封服务

案例展示
以ALC-0315包封circRNA为例
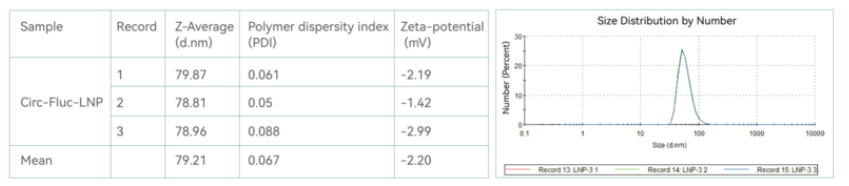
ALC-0315包封吉赛生物现货产品Circ-Fluc-LNP,粒径为79.21nm,PDI为0.067,Zeta电位为-2.20mV,包封率超95%。
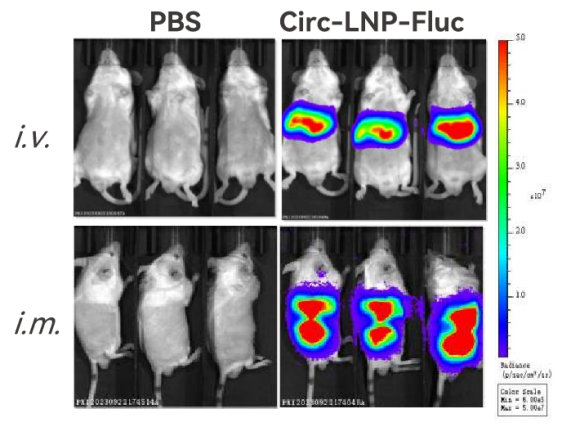
ALC-0315包封吉赛生物现货产品Circ-eGFP或Circ-Fluc,与Lipo8000相比,LNPs表现出更高的转染效率和生物相容性,并且通过不同的给药途径(静脉和肌肉)在体内显示出稳健的转染效率。
[1] Hou X, Zaks T, Langer R, et al. Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021;6(12):1078-1094. doi: 10.1038/s41578-021-00358-0.
[2] Chaudhary N, Weissman D, Whitehead KA. mRNA vaccines for infectious diseases: principles, delivery and clinical translation. Nat Rev Drug Discov. 2021 Nov;20(11):817-838. doi: 10.1038/s41573-021-00283-5.
[3] Eygeris Y, Gupta M, Kim J, et al. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022 Jan 4;55(1):2-12. doi: 10.1021/acs.accounts.1c00544.
[4] Suzuki Y, Ishihara H. Difference in the lipid nanoparticle technology employed in three approved siRNA (Patisiran) and mRNA (COVID-19 vaccine) drugs. Drug Metab Pharmacokinet. 2021 Dec;41:100424. doi: 10.1016/j.dmpk.2021.100424.
[5] Loan Young T, Chang Wang K, James Varley A, et al. Clinical delivery of circular RNA: Lessons learned from RNA drug development. Adv Drug Deliv Rev. 2023 Jun;197:114826. doi: 10.1016/j.addr.2023.114826.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn