
- 首页
- >
- GENESEED
- >
circRNA×肿瘤新抗原:开启肿瘤疫苗新时代
肿瘤疫苗通过递送肿瘤抗原重塑免疫微环境,增强抗原呈递,激活细胞/体液免疫应答,实现特异性杀伤与免疫监视。肿瘤疫苗可提供长期免疫记忆,并可同时靶向多种肿瘤,具有治疗和预防肿瘤的作用。 自20世纪80年代起,卡介苗(BCG)作为首个获批的治疗性癌症疫苗,成功应用于膀胱癌治疗;随后2010年,首例个性化肿瘤疫苗Sipuleucel-T获批,为转移性去势抵抗性前列腺癌提供了创新治疗方案,标志着肿瘤免疫治疗进入精准化阶段。 近年来,肿瘤疫苗研发领域取得显著突破,愈发受业界关注。肿瘤疫苗已在肺癌、恶性黑色素瘤、宫颈癌及卵巢癌等实体瘤治疗中展现持久的抗肿瘤效应,具有广阔的临床应用前景。而在肿瘤疫苗的研发中,灵活高效的肿瘤疫苗载体构建、肿瘤特异性抗原的精准筛选是两大关键问题。 新一代肿瘤疫苗平台:circRNA 当前肿瘤疫苗类型主要有: 合成肽类:短肽/长肽/多价肽; 核酸类:DNA/RNA; 细胞类:自体肿瘤细胞、树突状细胞(DC)疫苗。 其中,RNA疫苗已成为最具临床转化潜力的肿瘤疫苗类型之一。 RNA平台优势 ① 作用快速:可在细胞质内快速表达抗原,导致强大的免疫激活。 ② 安全性高:不整合到基因组,避免基因突变的风险;短暂存在于细胞中,降低T细胞耐受风险; ③ 灵活性高:可以通过序列和修饰优化设计,调节肿瘤疫苗的作用时间和效果; ④ 生产快速、成本低且可扩展:用于mRNA生产的设施可以快速生产针对任何给定靶标的疫苗,只需对工艺和配方进行极小的调整。 然而,线性mRNA在细胞中的半衰期相对较短,因此需要额外的核苷酸修饰以提高其稳定性,这提高了RNA疫苗生产的成本,但对RNA稳定性的改善有限。 与线性mRNA相比,环状RNA(circRNA)由于其闭环结构而表现出更高的稳定性,为肿瘤疫苗提供了优越的平台。多个团队已在临床前动物模型中验证了基于circRNA构建的肿瘤疫苗可更持久地表达抗原,诱导更强大的免疫反应。 基于circRNA开发的肿瘤疫苗概况
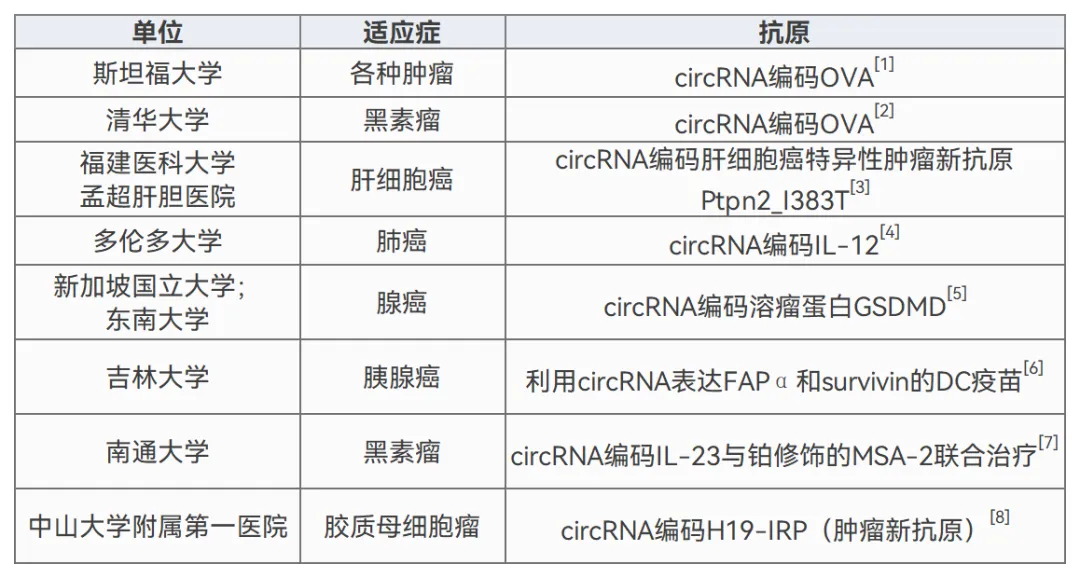
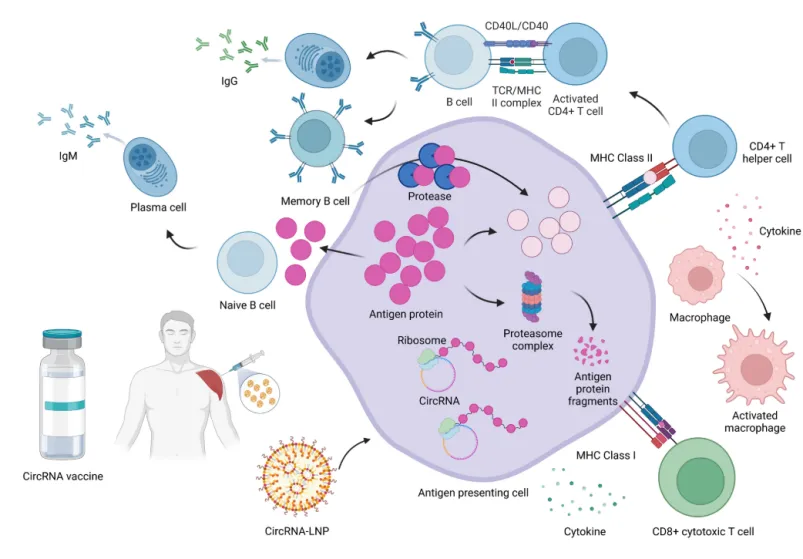
图1 circRNA体内递送和免疫激活。[9]
肿瘤疫苗开发的突破口:肿瘤新抗原
肿瘤抗原包括肿瘤相关抗原(TAA)和肿瘤特异性抗原(TSA)两类:
TAA在肿瘤和正常组织中均有表达,非癌症特异性,但在肿瘤细胞中异常高表达。
TSA,也被称为肿瘤新抗原,是肿瘤独有的,在健康组织中不存在。
相比之下,基于肿瘤特异性新抗原开发的疫苗,可诱导强效抗肿瘤免疫应答,且靶向性更强、安全性更优,在治疗肿瘤方面具有广阔的前景。如BioNTech/Genentech联合开发的个体化新抗原疫苗BNT122(Autogene cevumeran)已在胰腺癌临床Ⅰ期试验中展现良好疗效。[10]
挖掘免疫原性更强、特异性更高的抗原是肿瘤疫苗开发的重要突破口。肿瘤新抗原可由基因组突变、异常RNA剪接、翻译后修饰、表观遗传重塑或病毒ORF插入等途径产生。
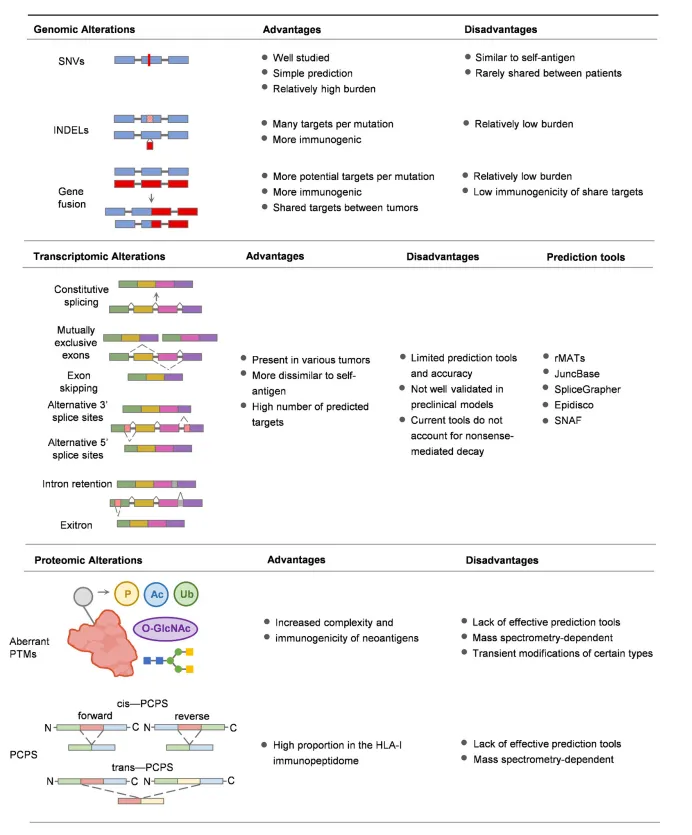
图2 肿瘤新抗原的主要来源[11]
基因突变衍生新抗原虽在高突变率的肿瘤中疗效显著,但其在低突变率的肿瘤中检出率低、肿瘤异质性导致的抗原丢失等问题限制了广泛应用。
非编码基因,占人类基因组的>90%,其中转录或可变剪接变化产生的非编码RNA(如circRNA、lncRNA)可具有编码新型多肽/蛋白的潜力,为肿瘤新抗原提供了丰富的来源。
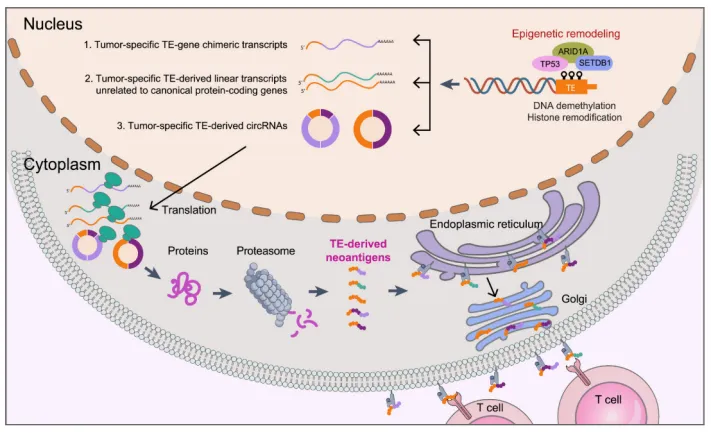
图3 肿瘤细胞中转座因子(TE)衍生新抗原的产生和呈递过程。[12]
挖掘新抗原的关键技术:多组学及生信分析
肿瘤新抗原的发现过程包括差异表达基因的挖掘、HLA分型、HLA结合预测和T细胞识别评估等。测序技术、生物信息学和蛋白/肽组学的进展为肿瘤新抗原的发现提供了技术支撑。
表观组测序:识别肿瘤特异性的表观调控网络,针对肿瘤特异性表观调控基因,挖掘肿瘤新抗原;
全外显子测序:识别肿瘤外显子突变来源的新抗原;
转录组测序:识别差异表达基因;发现异常高表达的非编码RNA;识别肿瘤中的异常剪接事件;
翻译组测序:挖掘潜在可编码的RNA,预测来源于非编码区或非编码RNA的新多肽/蛋白;
时空组测序:单细胞组测序和空间组测序可针对性分析肿瘤细胞中特异性表达的基因。
质谱技术:精确检测候选新抗原的免疫肽段,减少预测算法误差。
生物信息学工具:NetMHCpan等算法预测抗原与MHC结合亲和力。
circRNA×肿瘤新抗原
——强强联合开发肿瘤疫苗
福建医科大学孟超肝胆医院刘小龙和赵必星团队在肝细胞癌(HCC) 细胞中发现并验证了肝癌特异性的新抗原Ptpn2_I383T,并利用circRNA平台构建了肝癌新抗原疫苗circRNA 3×PTPN2。该疫苗稳定性高,且能在荷瘤小鼠体内持续表达抗原蛋白,有效刺激强大的抗肿瘤免疫反应,显著抑制肿瘤生长。[3]
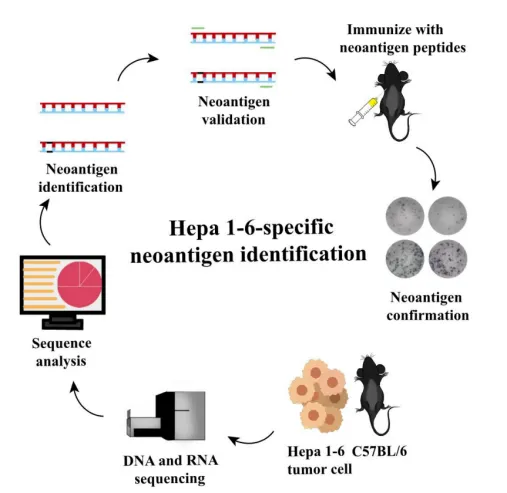
图4 Ptpn2_I383T的发现及鉴定流程[13]
H19-IRP发现及circH19-vac疫苗构建验证思路
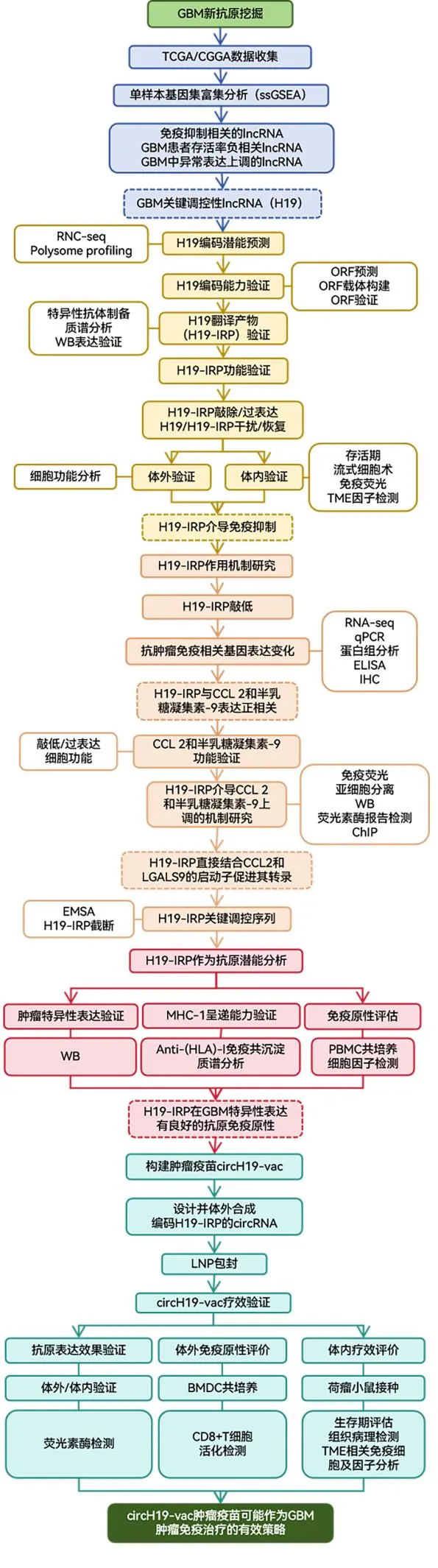
近年来,非编码RNA衍生肽作为新型肿瘤新抗原展现出巨大开发潜力。这类抗原具有肿瘤特异性高、免疫原性强等特点,为突破传统疫苗靶点匮乏提供了全新方向。
吉赛生物依托多组学整合技术平台(涵盖翻译组学、空间蛋白组学及单细胞测序),建立从RNA翻译潜能鉴定→候选新抗原筛选及验证→circRNA疫苗设计的全流程解决方案。吉赛生物提供CRO一站式服务,加速肿瘤疫苗从靶点发现到临床转化的全链条创新。
参考资料
[1]Amaya L, et al. Circular RNA vaccine induces potent T cell responses. Proc Natl Acad Sci U S A. 2023 May 16;120(20):e2302191120.
[2]Li H, et al. Circular RNA cancer vaccines drive immunity in hard-to-treat malignancies. Theranostics. 2022 Aug 29;12(14):6422-6436.
[3]Wang F, et al. Circular RNA-based neoantigen vaccine for hepatocellular carcinoma immunotherapy. MedComm (2020). 2024 Jul 29;5(8):e667.
[4]Xu S, et al. Tumor-Tailored Ionizable Lipid Nanoparticles Facilitate IL-12 Circular RNA Delivery for Enhanced Lung Cancer Immunotherapy. Adv Mater. 2024 Jul;36(29):e2400307.
[5]Feng Z, et al. An in vitro-transcribed circular RNA targets the mitochondrial inner membrane cardiolipin to ablate EIF4G2+/PTBP1+ pan-adenocarcinoma. Nat Cancer. 2024 Jan;5(1):30-46.
[6]Cai Z, et al. CircRNA-loaded DC vaccine in combination with low-dose gemcitabine induced potent anti-tumor immunity in pancreatic cancer model. Cancer Immunol Immunother. 2025 Jan 3;74(2):68.
[7]He, et al. Enhanced antitumor efffcacy of STING agonist MSA-2 by lipid nanoparticles delivering circular IL-23 mRNA and platinum-modiffed MSA-2 combination. Materials Today Bio. 30 (2025) 101446
[8]Chen J, et al. Lnc-H19-derived protein shapes the immunosuppressive microenvironment of glioblastoma. Cell Rep Med. 2024 Nov 19;5(11):101806.
[9]Xie J, et al. Circular RNA: A promising new star of vaccine. J Transl Int Med. 2023 Dec 20;11(4):372-381. doi: 10.2478/jtim-2023-0122. PMID: 38130633; PMCID: PMC10732498.
[10]Rojas LA, Sethna Z, Soares KC, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023;618(7963):144-150.
[11]Wu L, et al. mRNA-Based Cancer Vaccines: Advancements and Prospects. Nano Lett. 2024 Oct 7.
[12]Hu Z, et al. The neoantigens derived from transposable elements - A hidden treasure for cancer immunotherapy. Biochim Biophys Acta Rev Cancer. 2024 Sep;1879(5):189126.
[13]Chen H, et al. Personalized neoantigen vaccine combined with PD-1 blockade increases CD8+ tissue-resident memory T-cell infiltration in preclinical hepatocellular carcinoma models. J Immunother Cancer. 2022 Sep;10(9):e004389.

 购物车
购物车



 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn