
- 首页
- >
- GENESEED
- >
多组学技术:创新药物研发的加速器
新型疗法的研发为人类健康福祉带来曙光。然而药物研发道阻且长:动辄数十亿美元的巨额投入、平均超过十年的漫长周期以及仅有10%左右的成功率。
如何破解新药研发“三十魔咒”?测序、质谱和生物信息学技术的发展,提供了更高通量、更高灵敏度和更高精准度的多组学分析方法,可深入渗透到从靶点筛选到临床验证的全研发链条,大幅降低研发成本、压缩研发周期并提高成功率,为药物研发开辟了一条康庄大道。
/ 多组学技术赋能药物研发全流程加速 /
生物标志物发现与验证
生物标志物不仅可在分子水平上探索发病机制,还可准确、灵敏地评估早期、低水平损害,在疾病早期预警、预后疗效分析、疾病准确分期分型等方面具有独特优势。与没有生物标志物的试验相比,生物标志物的加入可使临床试验成功率几乎提升了一倍[1]。
组学技术(转录组、蛋白组、代谢组)通过大规模分析临床样本,筛选有统计学显著差异、易于检测的疾病相关分子(RNA、蛋白质或代谢物),可准确识别新的生物标志物。
应用案例
转录组/表观组/单细胞组/机器学习
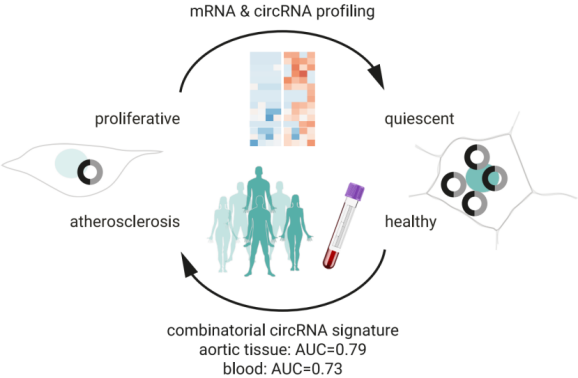
筛选并验证血管疾病circRNA生物标志物
研究人员利用RNA-seq结合circRNA检测算法分析人诱导多能干细胞(iPSC)分化为血管内皮细胞(EC)和平滑肌细胞(SMC)的细胞模型分化过程中受调控的circRNA,并利用ChIP-seq分析其受调控机制; RNA-seq、单细胞转录组测序(scRNA-seq)分析动脉粥样硬化患者主动脉和健康组织;结合机器学习,发现了区分动脉粥样硬化性斑块和健康动脉组织的标志物,以及识别动脉粥样硬化疾病的血液生物标志物[2]。
药物靶点挖掘与验证
药物靶点是指体内具有药效功能或能被药物作用的生物大分子。精确发现药物靶点对新药的开发至关重要。利用组学方法分析临床或细胞、类器官、动物模型样本,可高通量、无偏差地筛选出疾病相关分子,作为现有药物或新药候选靶点,开发新药物或老药新用。例如:
● 外显子测序发现疾病中的变异基因;
● 转录组和蛋白组分析识别疾病相关信号通路中的关键调控节点;
● 表观组测序发现具有可成药性的表观调控靶点;
● 翻译组测序挖掘由非编码RNA翻译且有疾病调控作用的隐秘多肽。
筛选出的候选药物靶点,需进一步验证功能与作用机制。该过程通常利用过表达、干扰、基因编辑等手段干预候选药物靶点的表达。多组学:
● 可表征干预后的表型效应:(单细胞组、空间组、转录组、蛋白组、代谢组)可分析疾病关键信号通路和代谢途径变化、识别生物标志物水平的差异。
● 研究药物作用机制:翻译组测序可分析关键基因的翻译调控机制,表观组测序可解释药物靶点的表观调控机制,为药理学分析提供依据。
应用案例
空间转录组/单细胞转录组
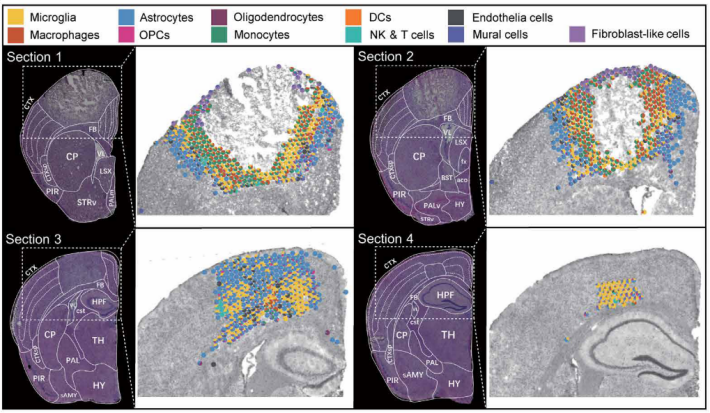
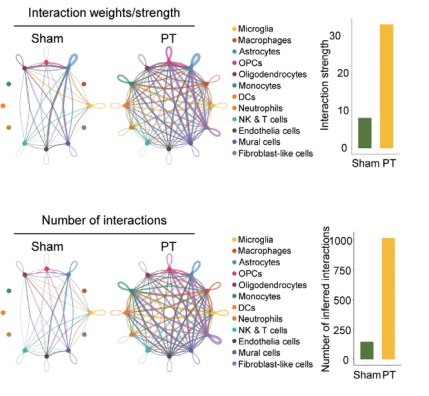
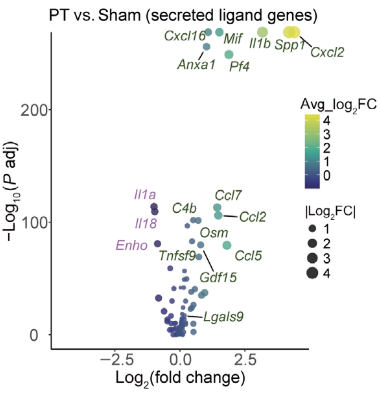
挖掘缺血性脑卒中的治疗靶点
研究人员利用空间转录组测序分析小鼠脑卒中的缺血脑半球,确定与特定组织学相关的基因表达谱。scRNA-seq通过鉴定细胞类型,丰富了缺血半球梗死周围区域的缺血相关基因表达的空间注释;分析细胞通讯中配体-受体相互作用,揭示了半乳糖凝集素-9(LGALS9)-细胞表面糖蛋白CD44是缺血性损伤后修复的关键信号通路。进一步研究验证了LGALS9是缺血性脑卒中修复的潜在治疗靶点[3]。
药物设计与优化
针对验证的靶点,可以设计多种具有预期生物/药理活性的候选药物,然后进行逐步优化,以增加特异性、提高活性和减少候选药物的副作用。在药物设计和优化过程中,多组学可对药物ADME(吸收、分布、代谢和排泄)进行评估,以识别、表征和筛选最佳的候选药物。
吉赛生物DRUG-seq(高通量药筛测序)平台,可在转录组水平并行评估多种候选药,同步获取候选药物的药理学特征、剂量效应及时间效应关系等多维度数据,相比常规单一指标的评估方法更精准,且显著缩短药物设计-优化周期,提升研发效率。
在RNA疗法开发中,优化翻译元件,提升蛋白质表达水平是药物设计和优化的关键。吉赛生物circRNA序列设计与优化平台结合翻译组技术(Ribo-seq、Nanopore RNC-seq、Polysome profiling/seq),通过解析翻译起始率、核糖体足迹及多聚核糖体负载能力,为circRNA药物设计提供从翻译元件高通量筛选到翻译效率定量评估的全流程解决方案,显著提升候选circRNA药物开发效率,增强候选药物有效性。
应用案例
翻译组/RNA-seq
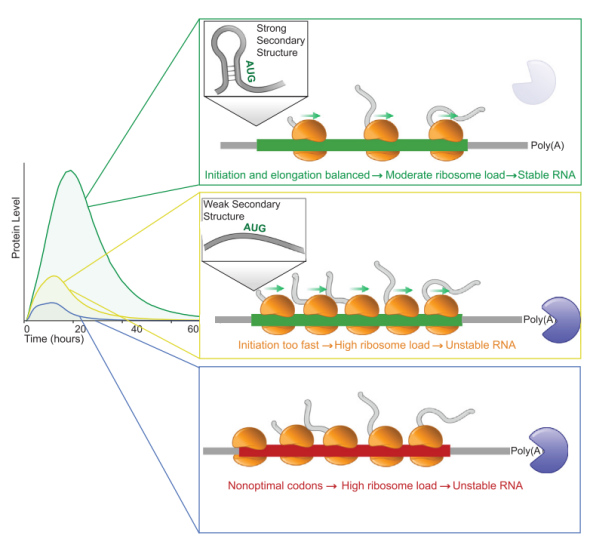
揭示mRNA药物CDS序列优化方向
研究人员利用polysome profiling技术和RNA-seq分析mRNA的核糖体负载和物理半衰期,发现CDS序列的差异影响mRNA的翻译起始和衰减,适度的起始/延伸速率和核糖体负载可得到最稳定和最高表达的mRNA。根据发现可进一步优化mRNA药物的蛋白表达[4]。
药物质量控制
保证药品安全、有效、质量可控是药品研发和评价应遵循的基本原则,其中,对药品进行质量控制是保证药品安全有效的基础和前提。
对于核酸药物,序列准确性是关键质量属性。高通量长度测序技术的发展,有利于核酸药物序列准确性及结构完整性的准确分析。如Nanopore三代测序测序技术,凭借其单分子长读长、直接测序、高通量及高准确性等优势,可实现核酸药物全序列覆盖度分析(含PolyA尾等复杂二级结构),同步分析宿主残留、RNA制备或降解等引入的核酸杂质。
circRNA、mRNA和DNA等药物制备均涉及质粒的质量分析,吉赛Nanopore全长质粒测序服务可助力快、准、狠的质粒质量分析:
● 快:24小时内完成超长序列(长达50kb)质粒测序;
● 准:无需预知序列和设计引物,可准确分析高GC含量、大片段重复、发夹结构等复杂序列,实现Q28级质量值(原始准确率97%-99.9%);
● 狠:仅需100ng的超低量DNA样本;批量样本测序成本远低于传统方法;可同时分析样品中的其它核酸杂质。
应用案例
Nanopore三代测序
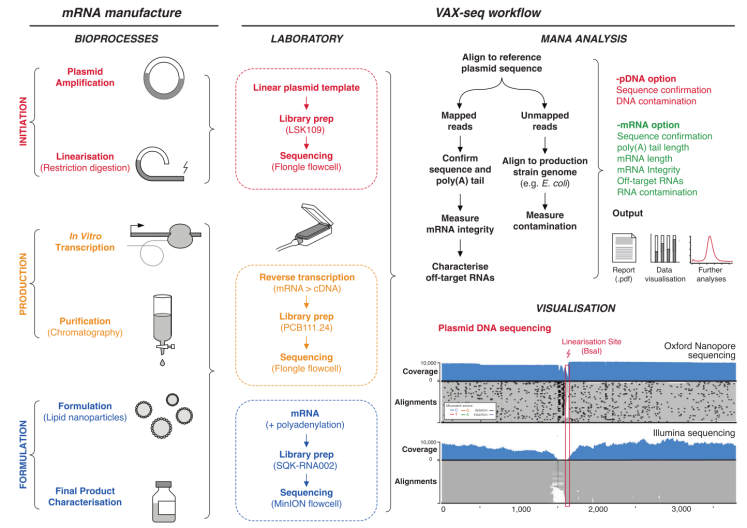
建立mRNA疗法的分析方法
研究人员利用Nanopore测序建立VAX-seq,可全面测量关键mRNA疫苗质量属性,包括序列、长度、完整性和纯度。基于Nanopore平台的RNA直接测序还可以分析mRNA化学修饰,包括核苷修饰的检测[5]。
临床前药学验证
临床前研究阶段通过细胞、类器官及动物模型系统评估候选药物的有效性与安全性。转录组、表观基因组、蛋白质组和代谢组等多组学分析方法,可精准鉴别脱靶效应与治疗响应生物标志物,关联解析药物作用下分子表型网络,全面解析药物干预引发的表型响应特征,为药效动力学评价和毒理学研究提供分子层面的客观依据。
应用案例
转录组测序
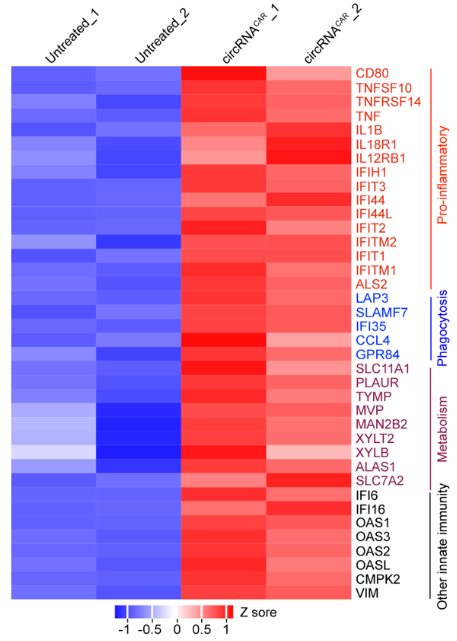
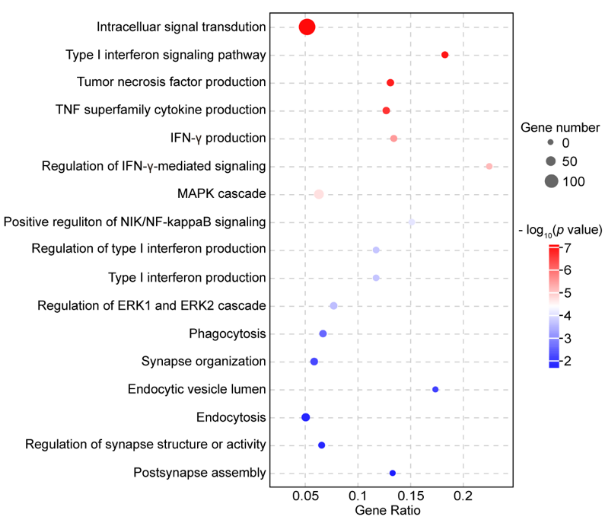
验证基于circRNA的CAR-T疗法有效性
研究人员通过转录组测序和生信分析,明确circRNAAnti-HER2-CARTHP-1转染的THP-1细胞中免疫反应相关的基因表达上调,验证了circRNACAR具有诱导巨噬细胞M1极化的潜力;circRNACAR治疗小鼠后,诱导促炎相关通路上调,验证了circRNACAR可将肿瘤微环境重塑为促炎状态,有利于肿瘤免疫治疗[6]。
临床试验
新药开发终期需通过系统化的临床试验设计,分阶段验证药物在人体内的治疗效能,最终确证创新药物的临床有效性和安全性特征。
多组学技术可深度解析临床试验样本,通过转录组、蛋白质组等分子层面对药物响应机制进行定量表征,评估药物暴露-效应关系;还可基于已知治疗模式的分子网络特征,发现新型治疗靶标和精准医学标志物,为适应症拓展提供转化医学证据链。
多组学技术通过建立分子机制与表型之间的定量关联,可以显著提升药物开发的靶向性、安全性和成功率。系统生物学视角不仅加速了从基础研究到临床转化的进程,更重要的是构建了可迭代优化的药物研发技术路线,为突破复杂疾病治疗瓶颈提供了全新解决方案。
吉赛生物依托系统生物学驱动的多组学技术平台,全流程助力创新药物研发。此外,吉赛生物建立的circRNA创新疗法研发平台,整合多组学技术,为circRNA创新疗法从靶点发现向IND申报的高效转化保驾护航。

参考文献
[1] Wong CH, et al. Estimation of clinical trial success rates and related parameters. Biostatistics . 2019;20(2):273-286.
[2] Northoff BH, et al. Circular RNAs increase during vascular cell differentiation and are biomarkers for vascular disease. Cardiovasc Res. 2025 Apr 29;121(3):405-423.
[3] Han B, et al. Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain. Sci Transl Med. 2024;16(733):eadg1323.
[4] Bicknell AA, et al. Attenuating ribosome load improves protein output from mRNA by limiting translation-dependent mRNA decay. Cell Rep. 2024;43(4):114098.
[5] Gunter HM, et al. mRNA vaccine quality analysis using RNA sequencing. Nat Commun. 2023;14(1):5663.
[6] Wang Y, et al. Synergically enhanced anti-tumor immunity of in vivo CAR by circRNA vaccine boosting. bioRxiv. 2024.07.05.600312.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn