
- 首页
- >
- GENESEED
- >
环状RNA:肺癌疗法开发的新突破口
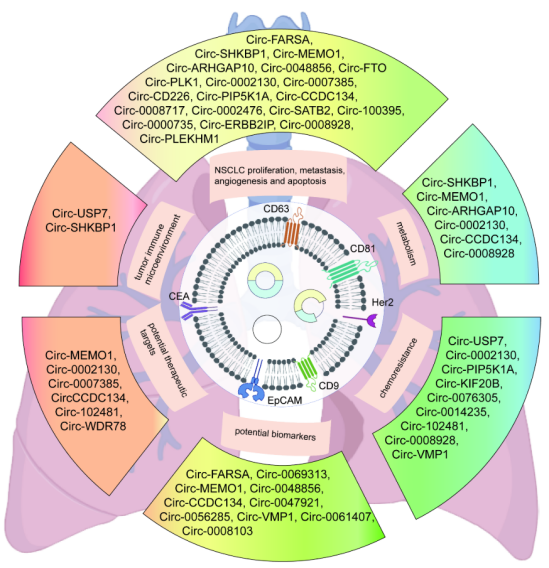
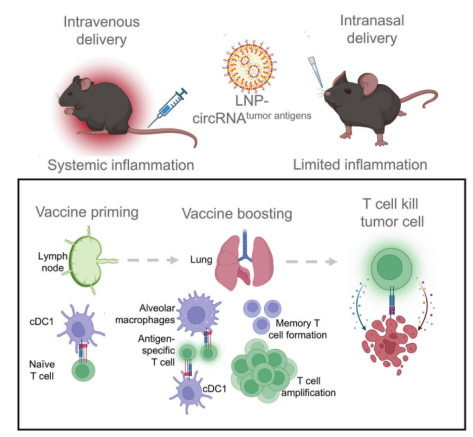
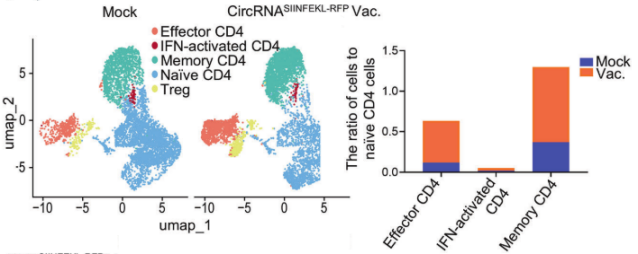
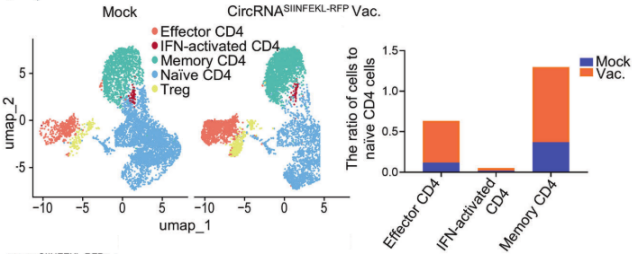
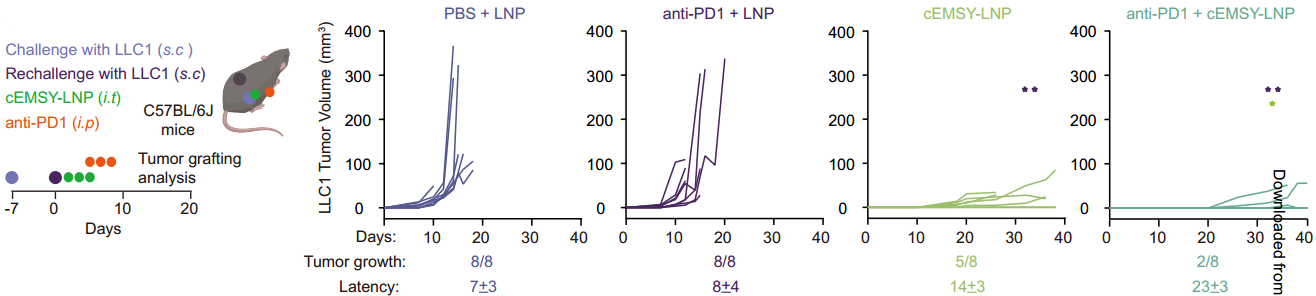
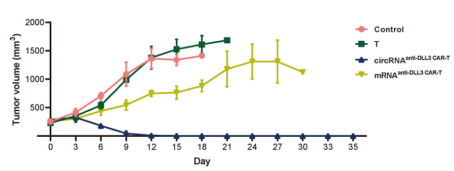
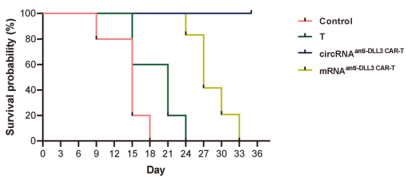
源自支气管腺体或粘膜的肺癌仍然是全球癌症的主要原因,2022年报告了248万例新发病例,占全球所有癌症诊断的12.4%[1,2]。小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)是肺癌的两种主要病理亚型,其中NSCLC占病例的80-85%[3]。 尽管手术、化疗、放疗、免疫治疗和靶向治疗等治疗方法取得了进展,但这些方法往往受到耐药性、复发和转移,导致低存活率等限制。因此,迫切需要更精准、有效、安全的靶向治疗策略。 / 肺癌治疗潜力新靶点——外泌体circRNA / 从外泌体入手可挖掘更多潜在靶点。外泌体是由细胞分泌的胞外囊泡,大小在40-160 nm之间,其大小、内容物、功能和起源各异。外泌体可以转运大量的miRNA、环状RNA(circRNA)和其他核酸、膜蛋白和小分子。当从细胞表面释放时,外泌体与质膜融合受体细胞,促进其内容物进入细胞质的运输。与非恶性细胞相比,癌细胞可以产生更多数量的外泌体。 图1 外泌体在肺癌病理中的作用[4] 多种circRNA被包裹在外泌体内,进行细胞间转运。具有表观调控作用的外泌体circRNA,由细胞外囊泡促进其进入肿瘤细胞,发挥促癌或抑癌功能,有望成为新的靶向治疗靶点。 图2 外泌体circRNA在NSCLC中的功能[5]。 案例 复旦大学附属肿瘤医院唐爽、宋少莉教授团队发现肺癌细胞缺氧诱导产生的外泌体circPLEKHM1,通过将巨噬细胞极化为M2型,驱动NSCLC转移。外泌体circPLEKHM1进入巨噬细胞后,促进了PABPC1-eIF4G的相互作用,从而促进了抑瘤素M受体(OSMR)的翻译,诱导巨噬细胞M2极化,加速了癌症的转移过程。团队利用ASO靶向circPLEKHM1治疗显著抑制了体内NSCLC转移,证明了外泌体circPLEKHM1可作为肺癌转移的治疗靶点[6]。 外泌体circRNA靶点挖掘及验证思路 靶点发现(缺氧条件下表达上调的circRNA) ● A549细胞低氧和常氧条件培养 ● 外泌体分离与鉴定(TEM、NTA、WB) ● 外泌体circRNA-seq筛选表达差异circRNA ● circRNA结构验证(RNase R耐受性) ● circRNA表达验证(RT-qPCR) 转录调控研究(调控circPLEKHM1转录的因子) ● 相关转录因子(HIF1A)敲低 ● ChIP-qPCR、双荧光素酶报告基因试验 功能验证(促进巨噬细胞极化和NSCLC转移) 体外 ● circPLEKHM1干扰、过表达 ● 外泌体提取、与细胞共培养 ● Transwell、巨噬细胞极化检测 体内 ● 小鼠全身转移模型构建 ● 氯膦酸盐脂质体清除巨噬细胞 ● 巨噬细胞M2标志物检测(SPECT/CT活体成像、RT-qPCR、流式细胞术、多重免疫荧光) 机制研究(诱导巨噬细胞M2极化的机制) ● circPLEKHM1过表达 ● RNA-seq、生信分析 ● OSMR敲减挽救实验 ● RNA pulldown-MS鉴定RNA互作蛋白 ● RIP验证蛋白-RNA互作 ● Co-IP、IF验证蛋白互作 ● Polysome profiling分析翻译调控作用 治疗潜力验证(靶向circPLEKHM1治疗效果) ● 心肌/胫骨注射转移模型构建 ● circPLEKHM1-ASO给药 ● 活体成像、Micro-CT ● TRAP染色、IHC 临床队列验证(在NSCLC患者中的临床意义) ● 110例NSCLC患者组织样本采集 ● RT-qPCR ● Kaplan-Meier分析 仍有大量潜在的circRNA治疗靶点等待挖掘。针对肺癌特异性表达的circRNA,开发靶向疗法,有望实现更强靶向性、更高疗效和更好安全性的肺癌治疗。吉赛生物致力于提供从circRNA靶点挖掘、验证到疗法开发的全流程服务,助力肺癌治疗的突破。 / 肺癌免疫疗法开发创新策略——工程化circRNA平台 / 癌症免疫疗法可利用免疫系统,靶向和消除癌细胞,是一种很有前途疗法。免疫检查点抑制剂(ICI)疗法是目前最常用免疫疗法,已被批准用于多种肿瘤的临床治疗。然而,由于肿瘤异质性和TME(肿瘤微环境)复杂性,仅解除免疫抑制可能无法恢复足够的抗肿瘤免疫,ICI单一疗法不足以控制肿瘤增殖。因此,需要增加T细胞或肿瘤杀伤细胞因子诱导抗肿瘤免疫。 circRNA具有编码和非编码的多功能性,结构固有的高稳定性、低免疫原性、快速生产、低成本等优势,可作为肺癌免疫疗法开发平台。 circRNA肺癌疫苗——精准给药策略 现有癌症疫苗多采用肌肉注射或静脉给药,易引发全身性炎症反应,且难以有效靶向肺部肿瘤。鼻腔黏膜是呼吸道的首道防线,支气管是90%肺癌起源部位,针对性的给药方式,特别是鼻内给药或气管内给药,可以提高药效和安全性: ①肿瘤源头局部激活免疫应答,可显著提升针对肺部病灶的治疗效果; ②避免药物肝首过代谢及在循环中的快速清除; ③避免药物在非靶组织中出现过高剂量的暴露,减小脱靶效应; ④有利于降低药物剂量,避免较高药物剂量或更频繁给药产生的耐药性。 案例一 清华大学林欣教授团队基于优化的LNP和编码SIINFEKL(OVA抗原表位肽)的circRNA,开发了全球首个鼻内给药的circRNA癌症疫苗。在肺癌模型小鼠中,该疫苗诱导了强大的抗肿瘤 T 细胞反应,精准清除肺部肿瘤;减轻了通常与静脉注射 mRNA疫苗相关的全身不良反应;还可调节 CAR-T细胞反应,增强对表达特定肿瘤相关抗原的肿瘤细胞的治疗效果[7]。 图3 单细胞测序显示,疫苗治疗组CD4和CD8效应细胞和记忆细胞的数量和比例增加;Gzma和Gzmb的表达水平升高,表明CD8 T细胞的抗肿瘤功能显著增强。 案例二 多伦多大学李博文团队研究团队开发了编码IL-12的LNP-circRNA药物,并验证了肿瘤内注射和气管内给药方式,均有效缓解Lewis肺癌小鼠模型的肿瘤进展,ICI和癌症免疫治疗的联合治疗,可显著诱导肿瘤消退[8]。 circRNA新ICD诱导剂——增强免疫治疗效果 免疫原性细胞死亡(ICD)可使肿瘤更容易被免疫系统识别。ICD通过损失相关分子模式(DAMPs),即受损组织或死亡细胞释放的内源性分子,作为识别和攻击的危险信号,促进树突状细胞(DC)的成熟和呈递,最终导致肿瘤特异性T细胞介导的抗肿瘤免疫应答。 案例 江苏省肿瘤医院许林、董高超、蒋峰团队研究在肺腺癌中发现了一种潜在的ICD诱导剂circRNA cEMSY,通过瘤内给药cEMSY-LNP,可使肺腺癌小鼠模型对anti-PD-1治疗显著增敏,具有开发增强癌症免疫治疗策略的潜力[9]。 circRNA作为ICD诱导剂研发思路: 关键circRNA(cEMSY)筛选与鉴定 ● 细胞ICD模型构建 ● 全转录组测序+生信分析 cEMSY诱导ICD能力验证 ● 体外过表达cEMSY,检测ICD标志物 ● 体内过表达cEMSY,检测肿瘤生长和生存期 cEMSY-LNP联合PD-1阻断疗法体内验证 ● circRNA合成与LNP包封 ● 建立肺腺癌小鼠模型,瘤内给药 ● 评估免疫记忆、肿瘤生长、生存期 cEMSY作用机制研究 ● 转录组测序分析先天抗病毒免疫反应 ● RNA pulldown检测互作蛋白 临床相关性分析 ● 多重免疫荧光分析65例肺腺癌患者样本 ● TCGA/GEO队列分析cEMSY与免疫细胞浸润、ICI响应率及生存预后的关系 图4 使用cEMSY-LNP和/或anti-PD-1治疗双侧荷瘤小鼠后,肿瘤体积变化。 基于circRNA的CAR-T疗法——靶向杀伤肺癌细胞 利用circRNA编码CAR蛋白,可以构建瞬时CAR-T细胞,可特异性杀伤肺癌细胞,减轻传统基于病毒载体CAR-T方法的局限性,如复杂的过程和整合基因、长期表达带来的副作用。此外,利用优化的递送系统,将编码编码CAR蛋白的circRNA体内递送到T细胞中,还可实现更安全、便捷的体内CAR-T疗法。 案例 DLL3是肺癌治疗的热门靶点。北京大学人民医院邱满堂、王俊联合南京医科大学附属医院孙明团队再次验证了DLL3在SCLC组织中高表达,在正常肺组织中表达极低。团队将编码anti-DLL3 CAR的circRNA递送到人类原代T细胞中,构建anti-DLL3 CAR-T细胞,通过尾静脉注射到小细胞肺癌小鼠模型中。与线性mRNA相比,基于circRNA的CAR-T细胞具有更强的肿瘤杀伤作用,可将人小细胞肺癌肿瘤完全消除[10]。 图5 基于mRNA和circRNA构建的CAR-T治疗后小鼠模型的肿瘤体积和小鼠存活分析[10]。 工程化circRNA为肺癌治疗提供了更多有效、安全的策略,有望成为肺癌疗法开发的新突破口。吉赛生物作为引领circRNA从科学研究到应用转化的先驱创新企业,致力于为全球药物研发合作伙伴,提供circRNA早期研究、工艺开发、质量研究、规模化生产等一站式CRO/CDMO解决方案,全流程助力精准肺癌疗法开发。 参考文献 [1] Bray F, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74:229-63. [2] Jacobsen MM, et al. Timeliness of access to lung cancer diagnosis and treatment: a scoping literature review. Lung Cancer. 2017;112:156-64. [3]Cao M, Chen W. Epidemiology of lung cancer in China. Thorac Cancer. 2019;10:3-7. [4]Xiao Q, et al. Revolutionizing lung cancer treatment: harnessing exosomes as early diagnostic biomarkers, therapeutics and nano-delivery platforms. J Nanobiotechnology. 2025;23(1):232. [5]Yin H, et al. Emerging roles of exosomal circRNAs in non-small cell lung cancer. J Transl Med. 2025; 23(1):490. [6]Wang D, et al. Hypoxic Exosomal circPLEKHM1-Mediated Crosstalk between Tumor Cells and Macrophages Drives Lung Cancer Metastasis. Adv Sci (Weinh). 2024;11(22):e2309857. [7]Li H, et al. Intranasal prime-boost RNA vaccination elicits potent T cell response for lung cancer therapy. Signal Transduct Target Ther. 2025;10(1):101. [8]Xu S, et al. Tumor-Tailored Ionizable Lipid Nanoparticles Facilitate IL-12 Circular RNA Delivery for Enhanced Lung Cancer Immunotherapy. Adv Mater. 2024;36(29):e2400307. [9]Zhang Y, et al. The circRNA cEMSY Induces Immunogenic Cell Death and Boosts Immunotherapy Efficacy in Lung Adenocarcinoma. Cancer Res. 2025;85(3):497-514. [10]Cai J, et al. Engineered circular RNA-based DLL3-targeted CAR-T therapy for small cell lung cancer. Exp Hematol Oncol. 2025;14(1):35.





 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn