
- 首页
- >
- GENESEED
- >
肾癌治疗新希望:吉赛客户基于circRNA开发原位CAR-M联合IL-2疗法,展现极大应用潜力!
/ 原位CAR-M联合IL-2疗法 /
联合疗法有望实现协同增效。例如,通过细胞因子维持CAR-M的M2型极化状态,可增强其肿瘤杀伤功能,减少副作用并提升疗效。
环状RNA(circRNA)是肿瘤免疫疗法的优质研发平台,已在CAR-T和肿瘤疫苗等展现出巨大潜力。circRNA的共价闭合环状结构使其高度稳定、抗核酸外切酶降解,并能在体内长效翻译蛋白,是实现体内CAR-M构建的理想技术平台。
近日,山东大学齐鲁医院姜新义、史本康、荆卫强研究团队利用circRNA平台开发了CAR-mLNP+CSR-mLNP/IL-2@gel疗法。该疗法利用巨噬细胞靶向纳米脂质颗粒(mLNP)包封编码IL-2R-TLR4嵌合信号受体(CSR)和anti-CA9 CAR的环状RNA,并设计水凝胶负载mLNP-circRNA和IL-2治疗剂,局部缓释IL-2,同时实现体内细胞编辑,生成特异性抗肿瘤的CAR-M细胞。在肾癌小鼠模型中,该疗法增强了肿瘤相关巨噬细胞(TAM)的特异性吞噬和细胞毒性能力,重塑了免疫抑制性肿瘤微环境,显著促进肿瘤消退,有望成为一种有效的新型肾癌治疗策略。

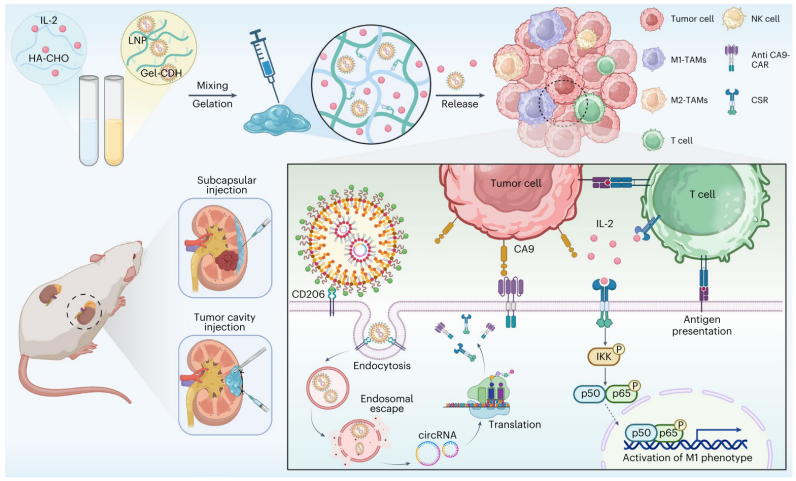
靶点发现与药物设计
筛选CAR靶点
生信分析显示,碳酸酐酶IX(CA9)在肾癌患者肿瘤组织中特异性高表达,与患者死亡率高和生存率低相关。CA9表达增加伴随CD68+巨噬细胞广泛浸润,是潜在的CAR治疗靶点。
设计CSR
创新的模块化嵌合信号传导受体(CSR)通过联合不同靶点受体,可选择性调节信号通路。将高亲和力的IL-2Rβ与促进巨噬细胞M1极化的TLR4受体融合,形成的IL-2R-TLR4 CSR可被IL-2激活,进而促进并维持巨噬细胞的M1极化。
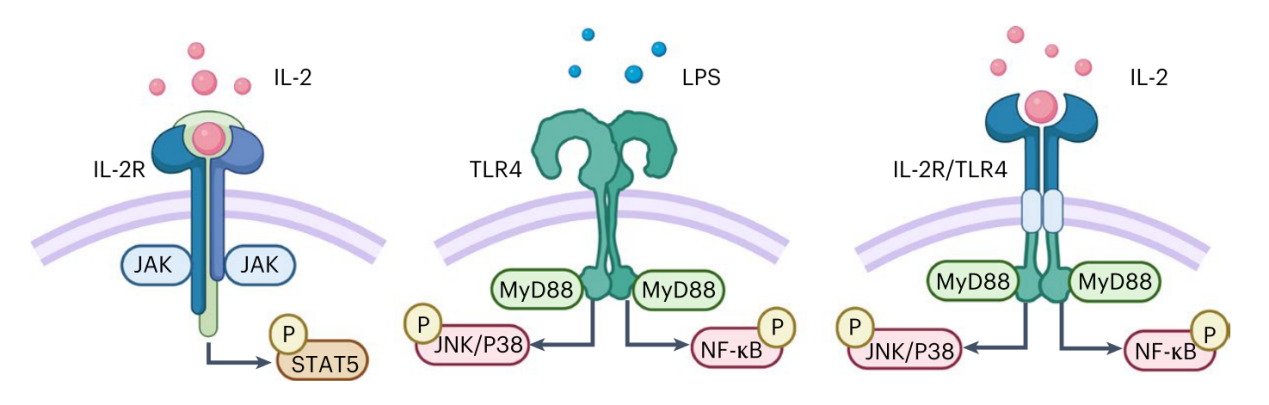
图1 IL-2受体、TLR4受体和CSR信号通路的示意图。
circRNA合成与质控
基于吉赛生物circRNA体外合成和纯化平台,高效体外合成分别编码IL-2R-TLR4 CSR和anti-CA9 CAR的circRNA。转染巨噬细胞后,用外源性IL-2刺激IL-2R-TLR4 CSR,验证嵌合受体在巨噬细胞上的稳定表达,及由外源性IL-2诱导的TLR4信号通路激活。
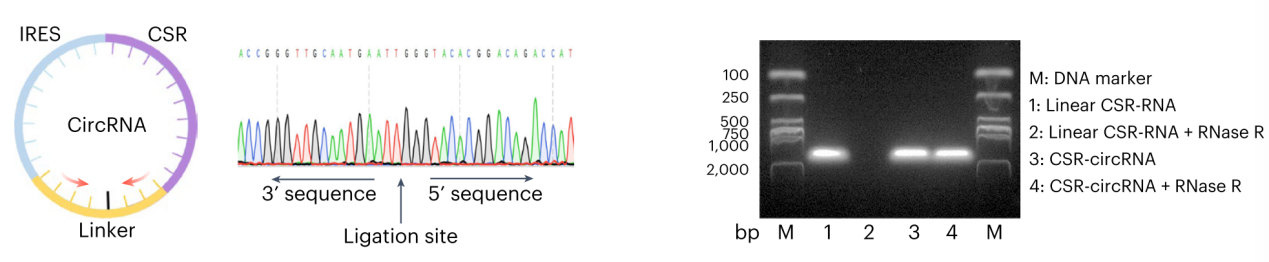
图2 circRNA结构示意图和验证结果。
递送策略优化与验证
提高靶向递送效率
设计合成新型可电离脂质NMS-C9H19,通过优化LNP配方包封circRNA,并添加甘露糖修饰,显著提升了circRNA在巨噬细胞中的靶向转染效率。
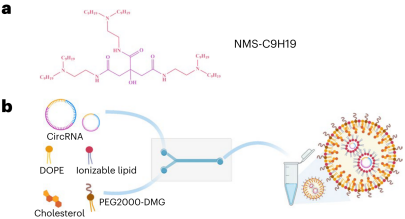
图3 a:NMS-C9H19分子式;b:LNP包封circRNA示意图。
实现缓释作用
构建基于氧化透明质酸(HA-CHO)和酰肼接枝明胶(Gel-CDH)的可注射生物基质水凝胶,用于负载IL-2和circRNA-mLNP,形成circRNA-mLNP/IL-2@gel,其累积释放率超过30%。该水凝胶具有可控的降解和力学性能,且止血性能优异。
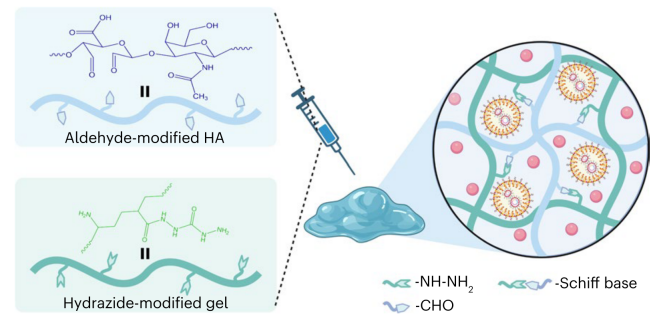
图4 负载circRNA-LNP和IL-2的水凝胶。
体外受体表达及功能验证
circRNA-mLNP递送至骨髓源性巨噬细胞(BMDM)和外周血单核细胞后,受体蛋白有效表达。IL-12刺激使巨噬细胞激活TLR4信号通路,M1极化水平上调,M2极化水平下调。
在表达人CA9的Renca小鼠肾癌细胞中,circRNA-mLNP处理增强了抗原特异性吞噬作用和炎症因子分泌。IL-2刺激显著减轻巨噬细胞凋亡,缓解CD8+T细胞抑制,并增强其活性和抗肿瘤能力。
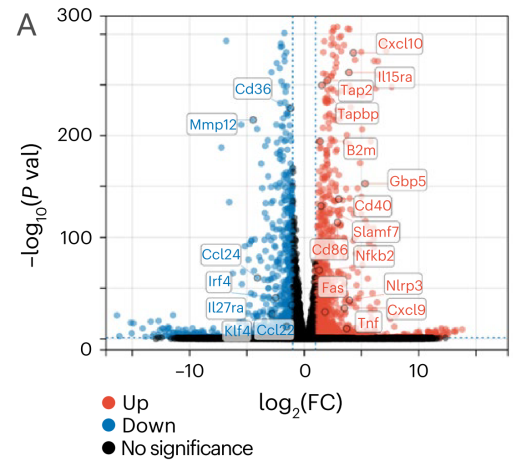
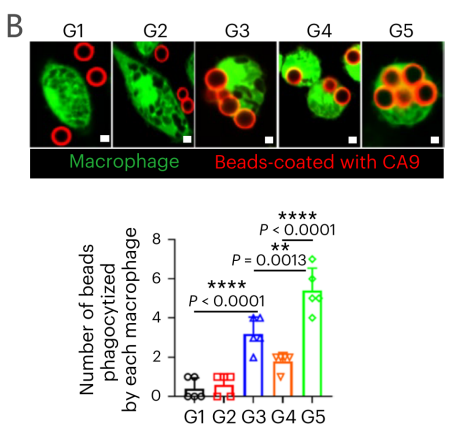
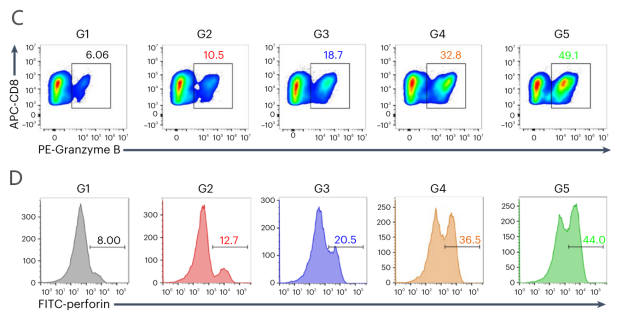
图5 A:联合治疗后,BMDM中差异表达基因的火山图;B:BMDM吞噬作用;C-D hCA9+Renca细胞和巨噬细胞共培养的颗粒酶B阳性CD8+T细胞(C)和穿孔素阳性CD8+T细胞(D)的流式细胞术分析。(G1: PBS处理组;G2:IL-2处理组;G3:IL-2和CAR-mLNP处理组;G4:用IL-2和CSR-mLNP处理组; G5:用IL-2、CAR-mLNP和CSR-mLNP处理组。)
体内有效性验证
术后抑制肿瘤生长和转移
将含CAR-mLNP、CSR-mLNP和IL-2的水凝胶注射到原位肾癌小鼠模型肾包膜下,评估其肿瘤抑制效果。结果显示,治疗后小鼠存活时间显著延长,M1巨噬细胞群增加5.52倍,M2巨噬细胞群减少;肿瘤组织中hCA9+肿瘤细胞比例降低,CD8+T细胞和CD4+T细胞数量和活性增加,Treg细胞减少。该联合治疗激活了巨噬细胞的抗肿瘤作用,增强了获得性免疫细胞功能,显著提升了总体抗肿瘤效果。此外,组织病理学检测显示,CAR-mLNP+CSR-mLNP/IL-2@gel治疗显著抑制原发性和肺转移肾肿瘤。
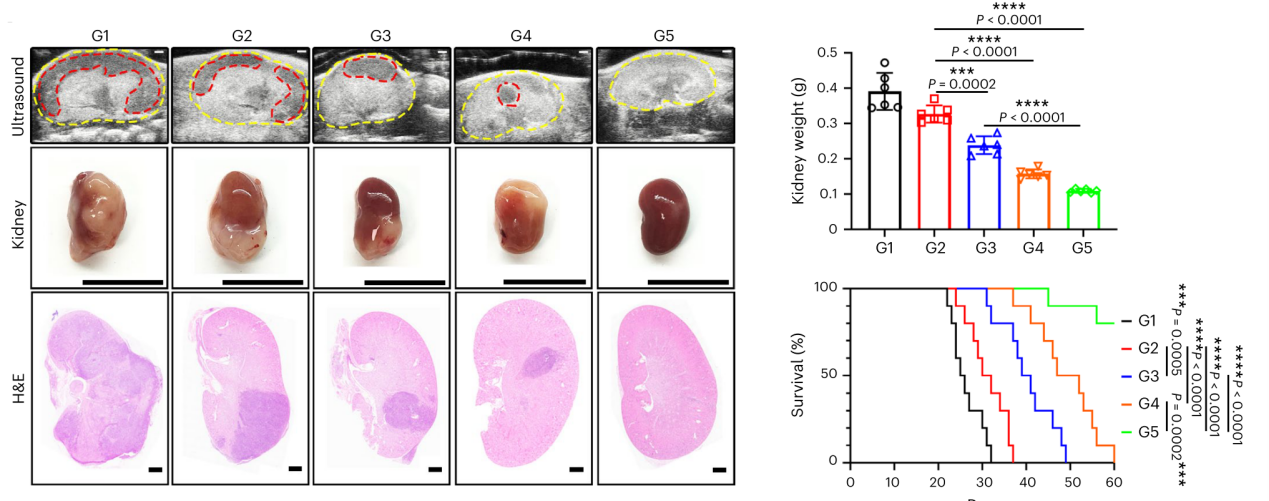
图6 将IL-2和circRNA-mLNP@水凝胶注射到肾包膜下的抗肿瘤与延长小鼠生存期的效果。
术后抗肿瘤功效
局部切除术是局部可切除肾癌的首选治疗方法。通过建立模拟肾部分切除的小鼠模型,用CAR-mLNP+CSR-mLNP/IL-2@gel水凝胶填充手术腔。病理结果显示,该组伤口区域肿瘤细胞显著减少,成纤维细胞增加,伤口愈合良好,基本防止了肿瘤复发,且显著延长了术后小鼠的中位存活期。
进一步研究了CAR-mLNP+CSR-mLNP/IL-2@gel在肾癌术后模型中控制肺转移的潜力。病理检测显示,治疗组肺部转移结节显著减少,表明该疗法可与手术无缝结合,实现多种肾癌疗法的协同作用。
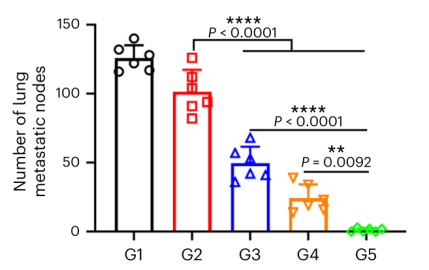
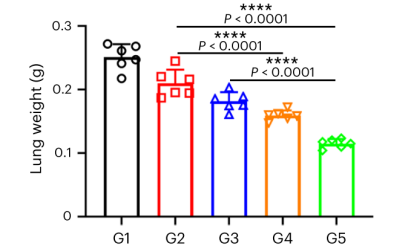
图7 术后将IL-2和circRNA-mLNP@凝胶注射到肾肿瘤腔中的抑制肺转移效果。
临床潜力验证
在基于患者来源异种移植物(PDX)构建的NOG-EXL人源化小鼠模型中,CAR-mLNP+CSR-mLNP/IL-2@gel处理显著抑制了肿瘤生长,验证了该疗法在临床相关环境中的有效性及临床应用潜力。
扩展多种肿瘤的应用
在肝转移和术后胶质瘤模型中,CAR-mLNP+CSR-mLNP/IL-2@gel验证结果显示,CSR受体在肝肿瘤和脑肿瘤内的巨噬细胞中成功递送并表达,表明该疗法可用于多种实体瘤治疗。
体内安全性评估
表达和功能特异性
流式细胞术分析显示,CAR巨噬细胞主要定位于肿瘤部位,未在肝、脾、肺、淋巴结或外周血中检测到,且CAR在TAM中表达显著升高,而在其他免疫细胞或肿瘤细胞中表达极低,体现了较高的靶向性和较低的脱靶分布。
吞噬靶向性实验表明,CAR巨噬细胞对hCA9+ Renca细胞的吞噬活性显著高于非hCA9表达细胞,对正常肾小管细胞的吞噬活性最低,进一步证实了其脱靶效应较低。
一般毒理学检测
血常规、生化分析及主要器官病理评估均未发现CAR-mLNP+CSR-mLNP/IL-2@gel引起的显著全身性不良反应。
参考资料
[1] Overwijk, W. W., Tagliaferri, M. A. & Zalevsky, J. Engineering IL-2 to give new life to T cell immunotherapy. Annu. Rev. Med. 72, 281-311 (2021).
[2] Diaz-Montero, C. M., Rini, B. I. & Finke, J. H. The immunology of renal cell carcinoma. Nat. Rev. Nephrol. 16, 721–735 (2020).
[3] Verra, N. et al. Infiltration of activated dendritic cells and T cells in renal cell carcinoma following combined cytokine immunotherapy. Eur. Urol. 48, 527–533 (2005).

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn