
- 首页
- >
- GENESEED
- >
神经“卫士”:环状RNA在神经退行性疾病中的关键角色
/ 主要病理特征 /
近年来,神经退行性疾病(NDs)发病率持续上升,全球约15%的人口受其不同程度影响。NDs常见类型有肌萎缩性脊髓侧索硬化症(ALS)、帕金森病(PD)和阿尔茨海默病(AD)。
NDs的特征为神经系统神经元进行性损伤和选择性功能障碍,可致使认知与身体机能慢性减退,主要发病机制涵盖蛋白质异常沉积、线粒体功能障碍、氧化应激及炎症等。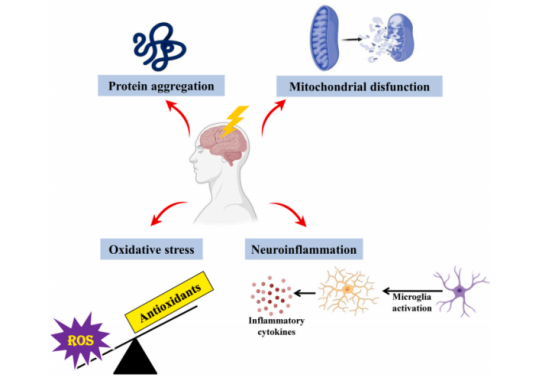
图1 NDs的发病机制[1]
神经炎症是神经退行性疾病的共同病理特征。多条信号通路及因子参与调控,促使脑内免疫细胞分泌TNF-α、IL-1β、IL-6等炎症细胞因子。
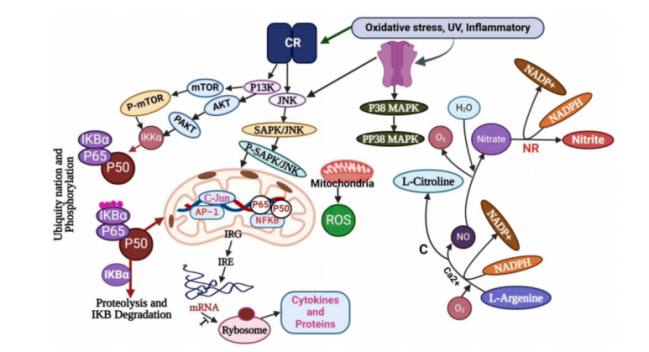
图2 NDs相关的炎症通路
(CR:细胞因子受体;IRG:炎症反应基因;IRE:炎症基因表达;T:翻译;C:钙调素;NR:硝酸盐还原酶)[1]
异常蛋白沉积也是NDs的关键病理特征之一,其积累可不同程度地干扰脑内神经元功能,进而引发认知与功能障碍。
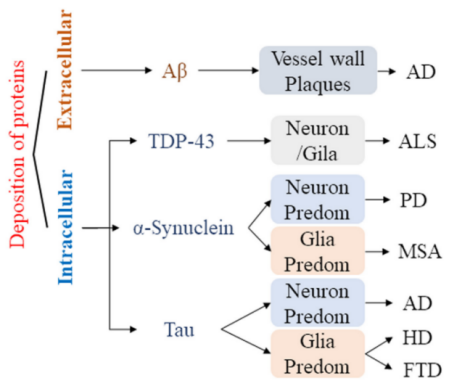
图3 各种NDs中的蛋白质沉积。AD:阿尔茨海默氏病; HD:亨廷顿病; PD:帕金森氏病; ALS:肌萎缩侧索硬化症; MSA:多系统萎缩; FTD:额颞叶痴呆。[2]
/ 环状RNA:解锁NDs创新疗法新路径 /
传统NDs疗法主要针对症状缓解,延缓或阻断疾病进展的有效手段有限。NDs致病机制复杂,血脑屏障的存在也限制了有效疗法的研发。
环状RNA(circRNA)凭借其稳定性与多功能性,成为生物医学领域热点,其在NDs治疗方面展现出巨大潜力。内源性circRNA可通过多种信号通路调节病理过程,为治疗提供重要参考。非编码circRNA可用于开发适配体、miRNA分子海绵及翻译调控因子等,其编码功能还能实现治疗性蛋白的持续表达,进而调节免疫反应、修复或替代受损神经元,从而改善NDs。
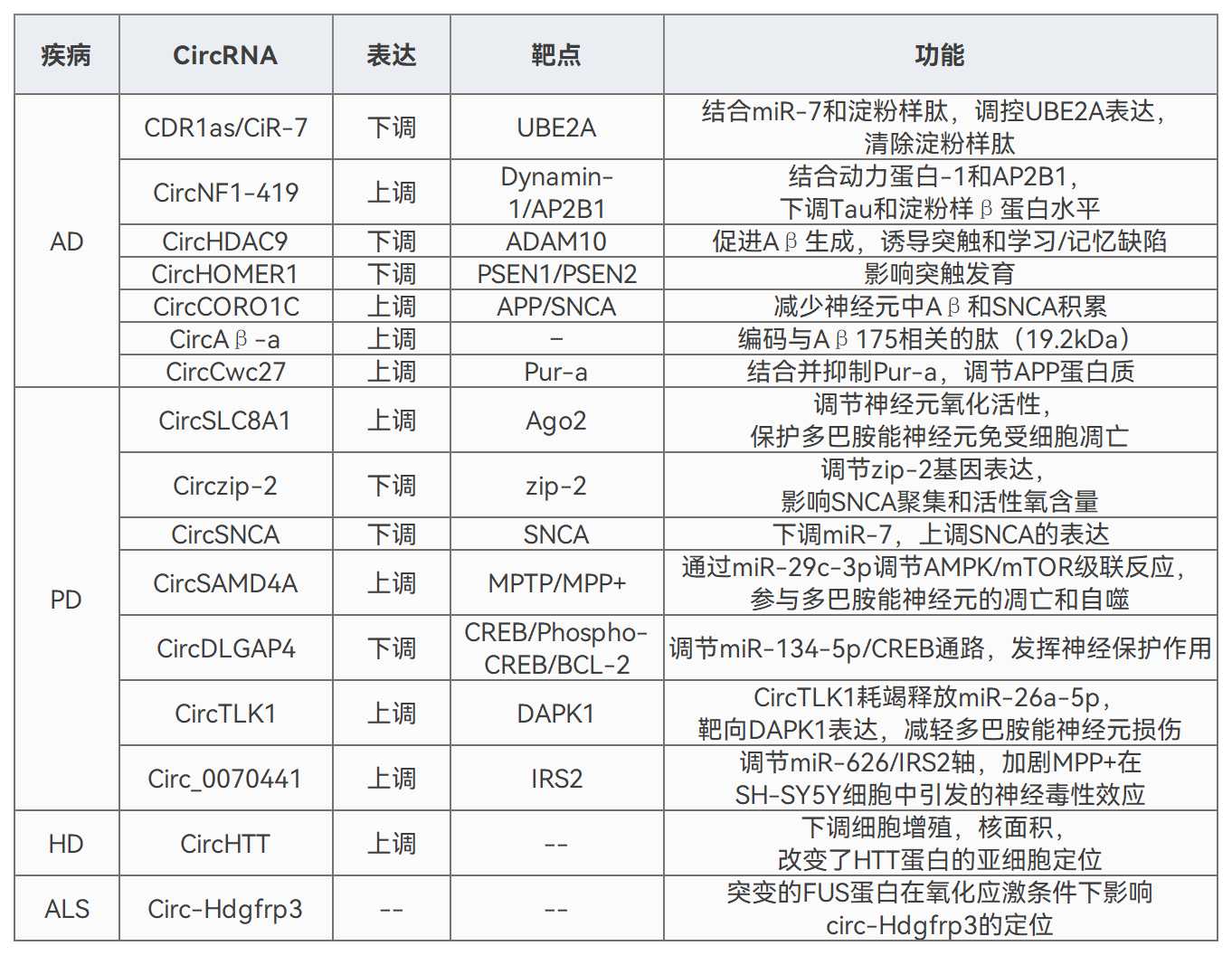
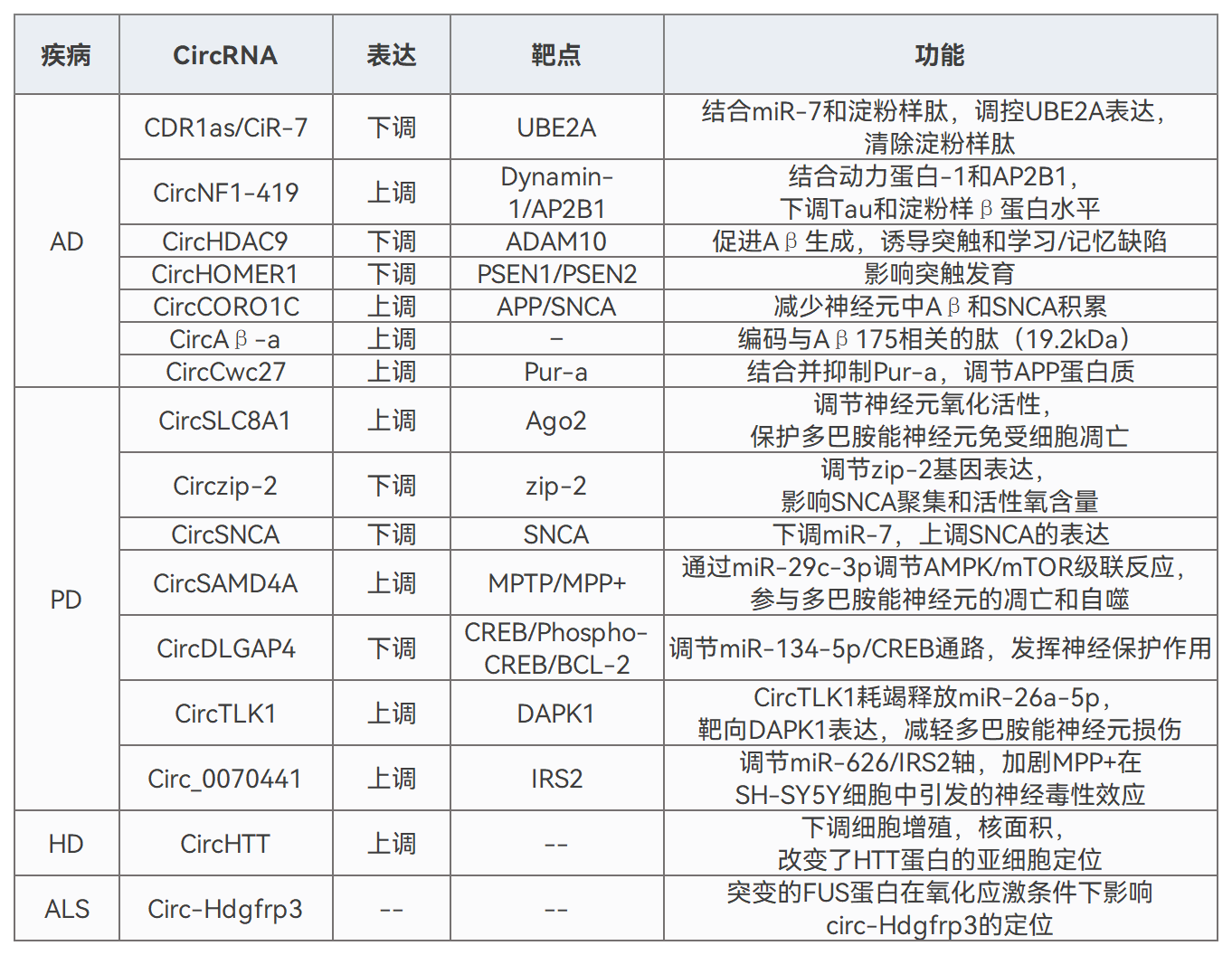
内源性circRNA在神经退行性疾病中的作用[2]
改善AD的环状RNA适配体
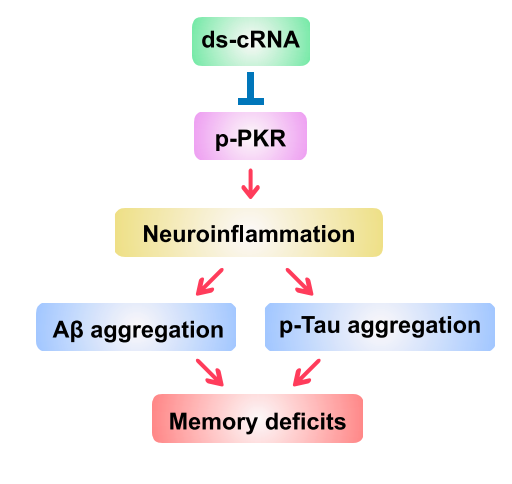
阿尔茨海默病(AD)是特征为进行性记忆减退和认知功能障碍,病理表现为β淀粉样蛋白(Aβ)斑块沉积和神经炎症的ND。小胶质细胞是神经炎症的主要参与者,在AD早期吞噬Aβ,但随着其慢性活化,Aβ清除率降低且分泌促炎细胞因子,进而导致突触损伤和神经元死亡。
Anti-Aβ单克隆抗体疗法效果有限且存在重度副作用风险。双链RNA(dsRNA)激活的蛋白激酶R(PKR)参与关键炎症通路,但目前小分子PKR抑制剂因不同程度的副作用,限制了其临床应用。因而需要更有效的针对性疗法。
中国科学院分子细胞科学卓越创新中心陈玲玲研究员团队设计了含有短双链区域的环状RNA(ds-cRNA)适配体,并利用腺相关病毒(AAV)递送至AD小鼠模型大脑,其穿过血脑屏障,靶向抑制过渡激活的PKR,有效增强AD小鼠模型的神经保护和空间学习和记忆能力。[3-5]
环状RNA创新疗法研发思路
● 药物发现
(ds-cRNA可作为PKR抑制剂)
现象发现:免疫应答与circRNA快速降解有关
机制研究:内源性ds-cRNA优先结合并抑制PKR激活
功能验证:过表达相关ds-cRNA可逆转PKR激活
● AD靶点验证
(PKR可作为AD治疗靶点)
相关性验证:PKR激活与AD进展正相关;
功能验证:PKR激活促进Aβ斑块聚集;PKR缺失改善AD表型。
● 候选药物设计
(AAV递送的ds-cRNA)
ds-cRNA设计:基于人源ds-cRNA构建载体;
AAV递送:AAV2/9海马体注射,递送神经元和小胶质细胞;AAV-PHP.eB静脉注射,穿透血脑屏障全脑递送;AAV-MG1.2双侧海马体注射,特异性靶向小胶质细胞。
●候选药物评价
(ds-cRNA有效性及安全性)
传统药物对比: PKR抑制剂C16减轻神经炎症,但存在副作用。
安全性评估:AAV-ds-cRNA药物处理无动物死亡,无急性毒性。
有效性验证:AAV-ds-cRNA有效改善AD表型,保护神经元并改善认知能力。
治疗窗口与长效性研究:早期维持神经元稳态;晚期减少神经元丢失;单次给药疗效持续6个月以上。
药理学表征:ds-cRNA抑制神经元和小胶质细胞中PRK激活,减轻神经炎症。
改善视网膜神经退行性疾病的LNP-circNGF
视网膜神经退行性疾病,如青光眼,因视网膜神经节细胞(RGC)的进行性变性,可致视力丧失。RGC是视网膜向大脑传递视觉信息的唯一输出神经元。神经保护是预防失明的关键,但目前缺乏有效的神经保护策略。
神经生长因子(NGF)对神经元健康和存活具有保护作用,其重组蛋白疗法已用于治疗RGC变性疾病。然而,重组蛋白生物利用度有限,且半衰期较短,需持续长期输注以维持治疗水平,因而临床转化困难。基于病毒的基因治疗虽可递送神经营养因子,但存在遗传毒性、免疫原性、基因组不可逆改变及表达调控难以调控等问题。
环状RNA凭借优于线性mRNA的稳定性,作为非基因整合策略,能在神经细胞中安全、持续表达神经营养因子。
中山大学中山眼科中心谢志团队设计了脂质纳米颗粒递送编码NGF的circRNA(LNP-circNGF),将其注射入小鼠模型玻璃体内,可有效保护RGC和轴突免受损伤诱导的变性,疗法显著优于重组NGF蛋白治疗,且无视网膜毒性。单细胞转录组学显示,LNP-circNGF可增强视觉感知相关的基因表达,减少创伤相关的变化。该研究表明基于circRNA的疗法有望用于眼部神经退行性疾病治疗,并为其他眼部疾病干预提供了新平台。[6]
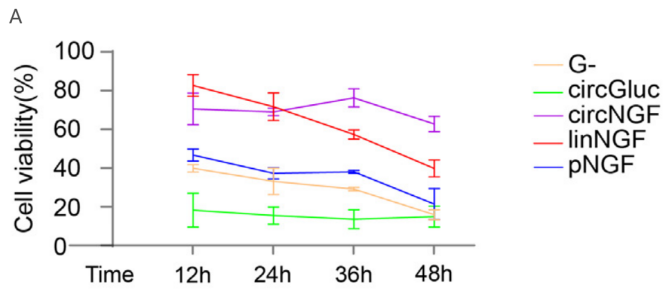
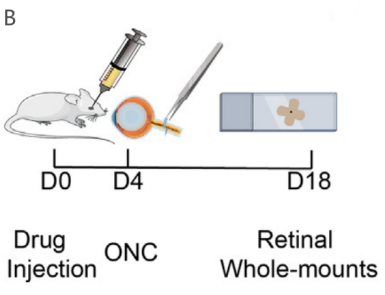
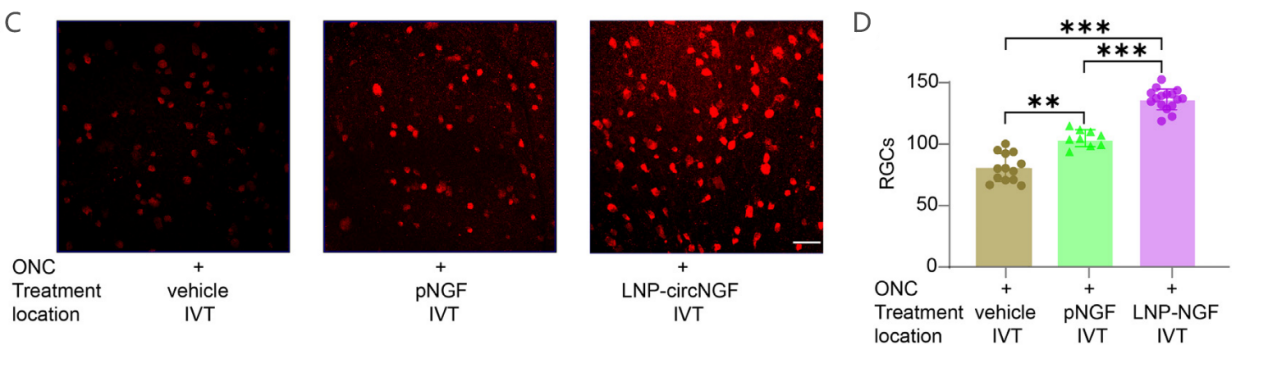
A:circNGF提高葡萄糖饥饿后HT22细胞存活率,效果优于线性mRNA(linNGF)和重组NGF蛋白(pNGF);C-D: LNP-circNGF治疗显著提高RGC存活率,效果优于pNGF。
/ 环状RNA技术平台:加速创新疗法研发 /
环状RNA技术兼具持久有效性与安全性,为神经退行性疾病治疗提供新思路。加快科研成果的转化应用和创新疗法的研发,有望精准有效治疗NDs,改善患者生活质量和延缓疾病进展。
参考文献
[1] Singh K, et al. Advances in gene therapy approaches targeting neuro-inflammation in neurodegenerative diseases. Ageing Res Rev. 2024;98:102321.
[2] Xiao F, et al. Regulatory mechanism of circular RNAs in neurodegenerative diseases. CNS Neurosci Ther. 2024;30(4):e14499.
[3] Liu CX, et al. Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity. Cell. 2019;177(4):865-880.e21.
[4] Guo SK, et al. Therapeutic application of circular RNA aptamers in a mouse model of psoriasis. Nat Biotechnol. 2025;43(2):236-246.
[5] Feng X, et al. Circular RNA aptamers targeting neuroinflammation ameliorate Alzheimer disease phenotypes in mouse models. Nat Biotechnol. 2025.
[6] Jiang W, et al. Circular RNA-based therapy provides sustained and robust neuroprotection for retinal ganglion cells. Mol Ther Nucleic Acids. 2024;35(3):102258.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn