
- 首页
- >
- GENESEED
- >
环状RNA与病毒的49年:从“共存”到“对抗”
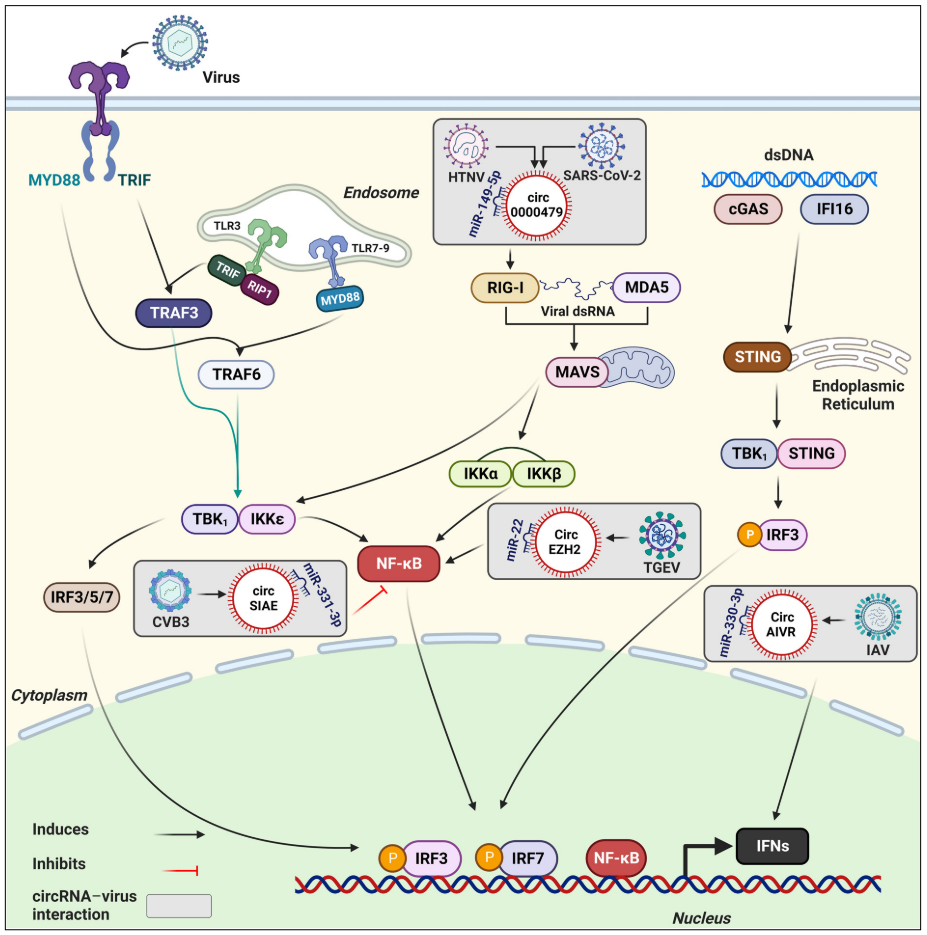
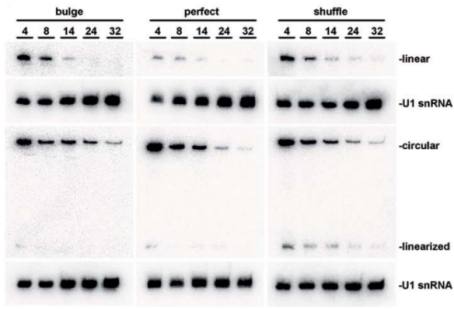
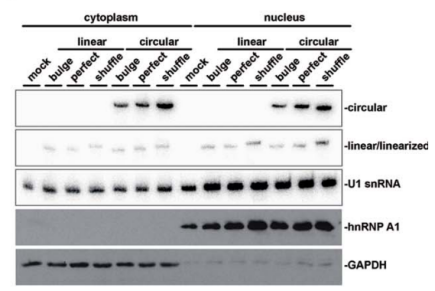
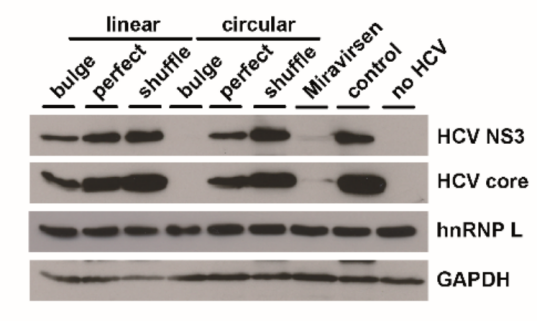
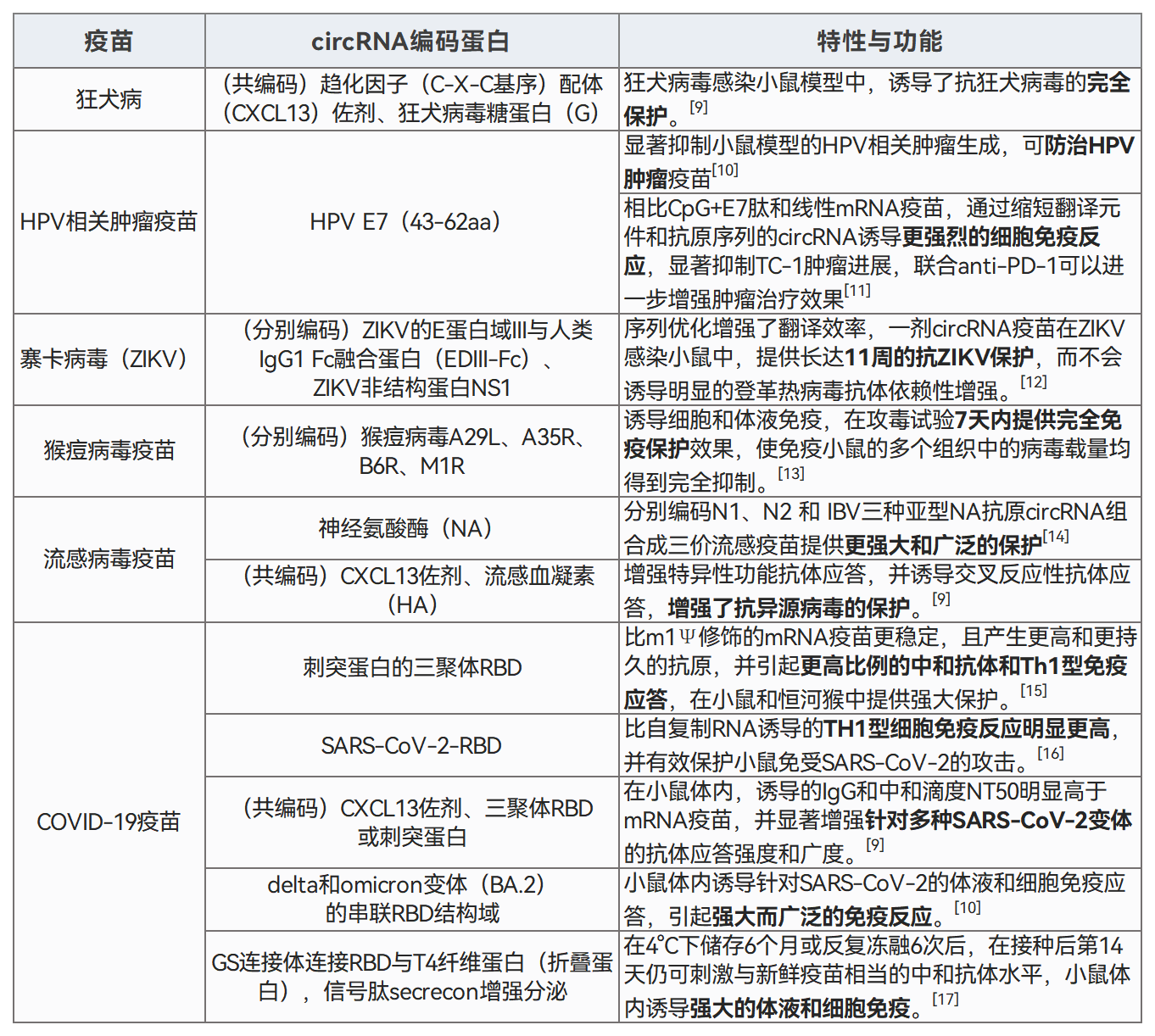
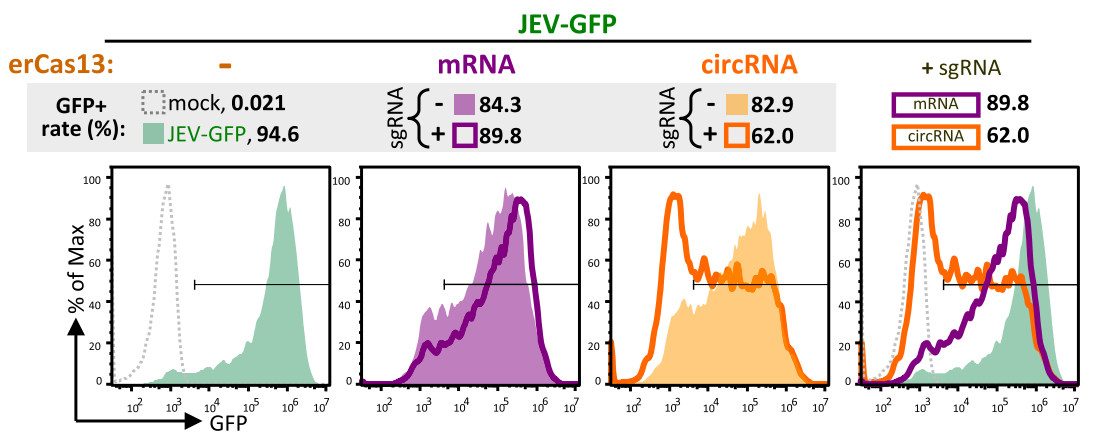
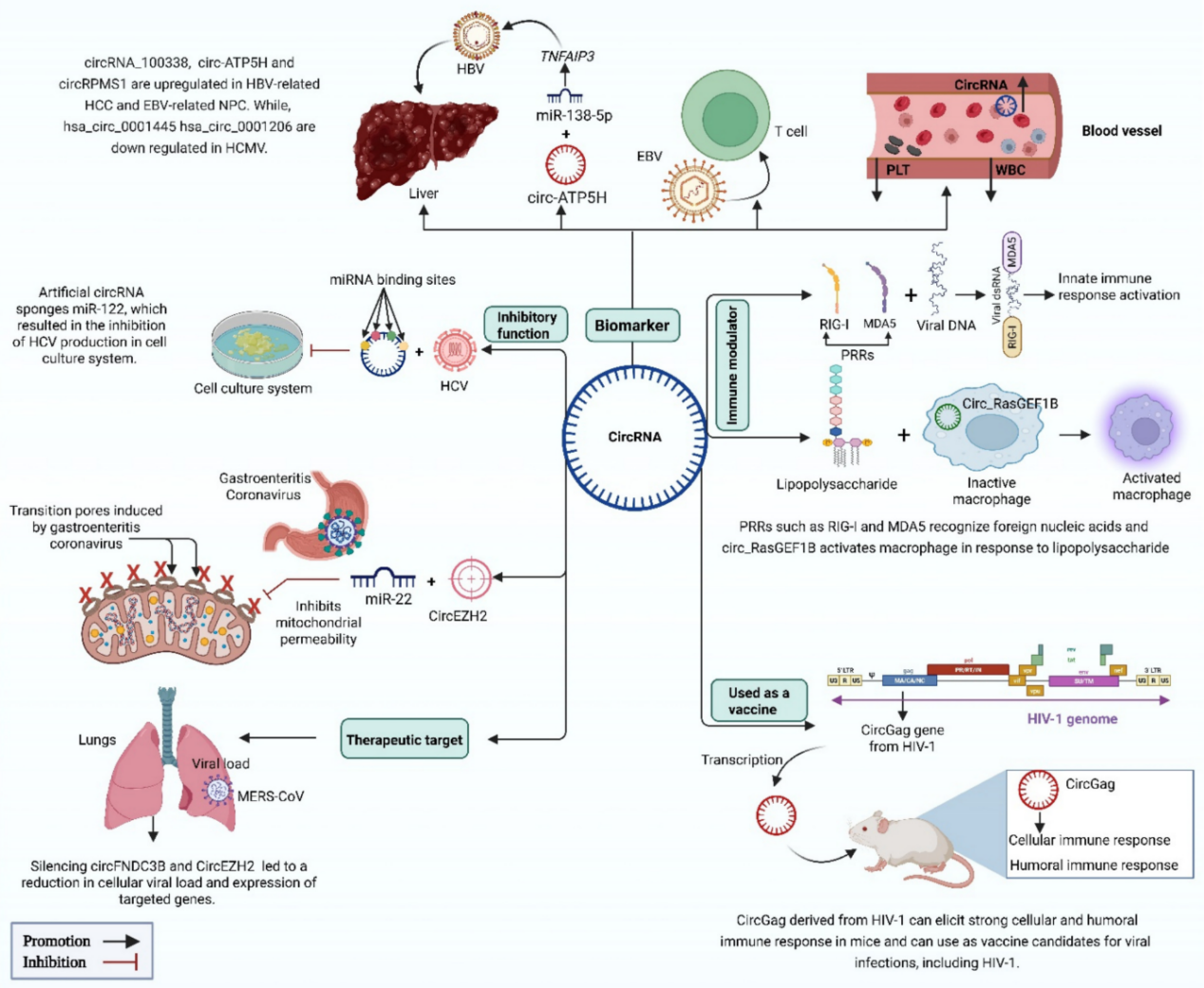
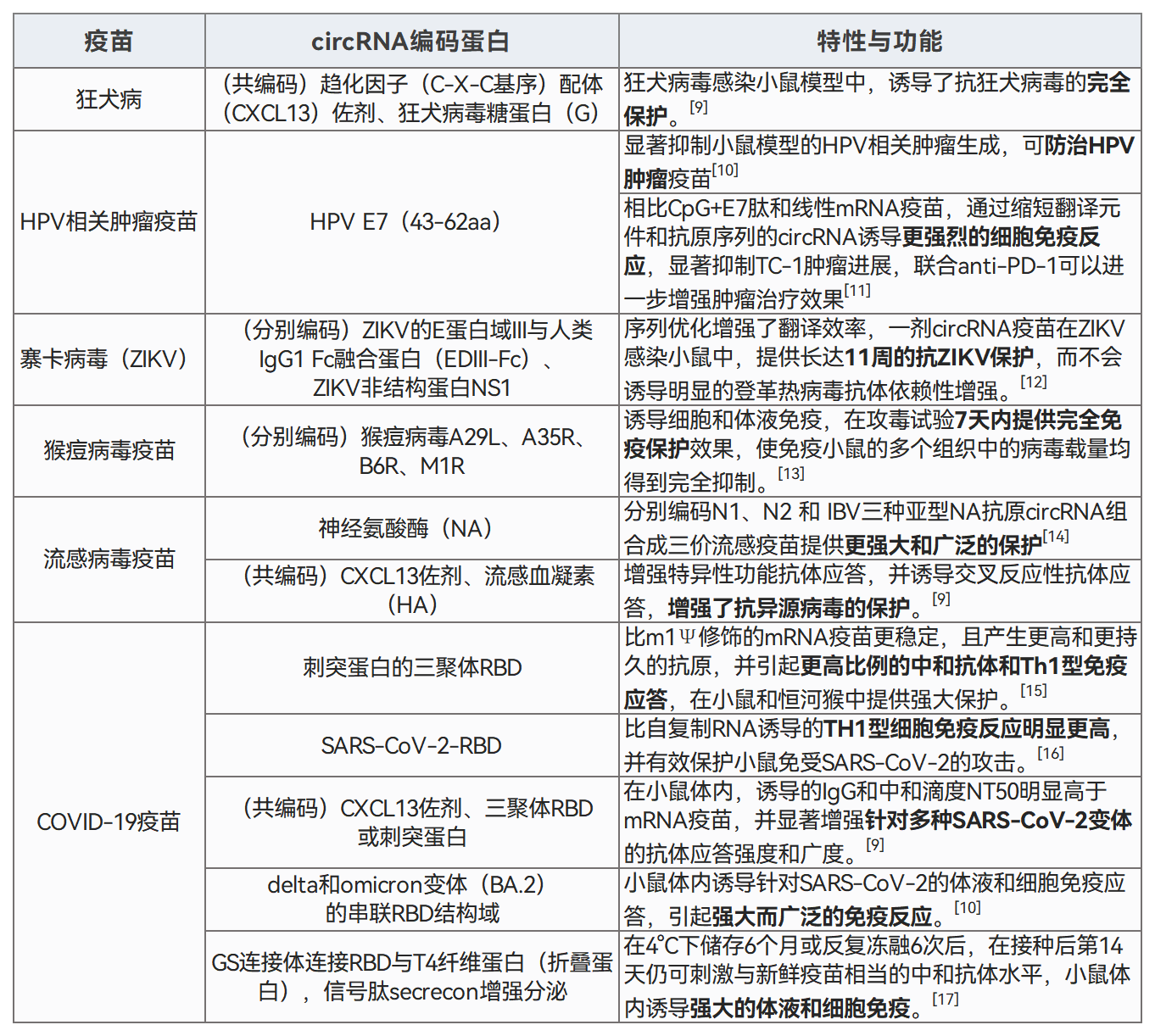
/ circRNA在抗病毒中的应用 / 病毒感染生物标志物与治疗靶点 在病毒感染过程中,部分circRNA表达异常,通过分子海绵作用或结合病毒RNA,调控病毒的扩增和致病过程。 circRNA与病毒感染息息相关,且在细胞及体液中可存留较长时间。因此,病毒感染相关的circRNA是早期鉴定、无创诊断和预后的理想生物标志物,同时也是抗病毒治疗的理想靶点和候选药物。 病毒感染的潜在circRNA生物标志物和治疗靶点[1] 注:HBV:乙型肝炎病毒;EBV:Epstein-Barr病毒;HCV:丙型肝炎病毒;IAV:甲型流感病毒;H1N1血凝素1神经氨酸酶1;HPV:人乳头瘤病毒;KSHV:卡波西肉瘤相关疱疹病毒;HTNV:汉坦病毒;HCMV:人巨细胞病毒;HSV-1:单纯疱疹病毒1;CBV3:柯萨奇病毒B3。 人源环状RNA免疫调节剂 circRNA也可通过结合RBP或miRNA,调控免疫基因表达,影响机体抗病毒免疫应答。 潜在免疫调节剂 circ_0000479可以隔离miR-149-5p并调节RIG-I表达,抑制HTNV和SARS-CoV2病毒复制[2,3]。 circRNA AIVR主要通过隔离miR-330-3p,增强CREBBP表达,从而促进IFN-β的产生,抑制IAV复制[4]。 circSIAE可以通过靶向结合miR-331-3p和TAOK2并影响p-NF-κB水平,抑制CVB3复制[5]。 传染性胃肠炎病毒(TGEV)感染后,circEZH2可以通过结合miR-22促进NF-κB的活化[6]。 这些具有免疫调节功能的人源circRNA,通过进一步优化验证和体外制备,有望开发更高效、安全的免疫调节剂,以增强机体抗病毒免疫应答,为相关疾病的防治提供新策略。 图2 circRNA参与代表性病毒感染的先天免疫调节机制。[7] circRNA分子海绵抗病毒 基于circRNA天然的非编码功能,可以人工设计并体外合成circRNA分子海绵或适配体,靶向结合相关miRNA或蛋白,调控关键基因的功能,影响宿主的免疫反应或抑制病毒扩增与活化。这些circRNA分子海绵有望作为新型抗病毒药物。 设计circRNA分子海绵案例 miRNA-122在肝细胞中高表达,通过结合HCV基因组保护其免受外切酶降解,从而促进病毒复制与蛋白合成。靶向miRNA-122的LNA/DNA混合寡核苷酸药物Miravirsen已进入临床试验阶段。 德国吉森大学Rossbach O.研究团队设计并体外合成含有miRNA-122完全或不完全互补序列的circRNA分子海绵[8]。 稳定性高:circRNA稳定性显著高于线性RNA,在HuH 7.5细胞中,circRNA分子海绵总半衰期为18.7-22.7 h,对应线性RNA的半衰期为11.3-13.2 h。 图3 转染到HuH-7.5细胞后,体外合成的circRNA和对应线性RNA的降解情况。 灵活性高:转染到细胞后,体外合成的circRNA同时分布于细胞核和细胞质,有利于更彻底清除病毒,或调控细胞核与细胞质的过程,发挥更广泛的用途。 图4 转染到HuH-7.5细胞后,体外合成的circRNA和对应线性RNA的分布情况。 有效性强:HCV感染HuH 7.5细胞模型中,含有不完全miRNA-122结合位点的circRNA(bulge circRNA)靶向隔离miRNA-122,显著降低病毒蛋白的水平,效果优于Miravirsen和对应的线性RNA。 图5 体外合成的circRNA、线性RNA、Miravirsen和HCV RNA共转染到HuH-7.5细胞5天后,HCV NS3和core蛋白丰度。 circRNA疫苗 circRNA还可设计用于编码各种病毒抗原或抗病毒蛋白,在宿主体内稳定翻译相应蛋白,激活宿主免疫系统。 ① 相比重组蛋白疫苗 更强的有效性:circRNA疫苗能持续表达抗原,延长抗原呈递时间,有效激发适应性免疫反应。重组蛋白疫苗则因代谢清除,抗原刺激时间短,需较大剂量且生物利用度低。 更高的生产效率:circRNA疫苗的生产过程相对简单,而重组蛋白疫苗的生产涉及复杂的蛋白表达和纯化等工艺,耗时长且成本高。 ② 相比灭活病毒疫苗 更高的安全性:circRNA疫苗不含病毒成分,不存在病毒复活或感染的风险。灭活病毒疫苗虽然经过灭活处理,但仍保留病毒的完整结构,存在病毒复活的风险。 更强的针对性:circRNA疫苗可通过序列设计和修饰调节免疫原性和翻译效率,实现理想免疫反应。灭活病毒疫苗免疫原性和作用效果相对固定,难以精细调控。 更高的灵活性:circRNA疫苗能快速调整抗原序列应对病毒变异或新型病毒。灭活病毒疫苗则需重新筛选病毒株并灭活,过程繁琐。 ③ 相比mRNA疫苗 更高的稳定性:circRNA疫苗的共价闭合环状结构使其稳定性更高,可持久稳定表达抗原,且便于储存和运输。而mRNA疫苗即使经过修饰,半衰期仍较短,易被RNase降解,抗原表达时间有限。 circRNA疫苗开发案例 CRISPR系统介导抗病毒治疗 人类致病性病毒中最致命或最常见的大多数是RNA病毒,如HIV病毒、流感病毒、寨卡病毒、冠状病毒、埃博拉病毒。 CRISPR-Cas13系统可在生物体内靶向切割RNA,具有抗病毒的潜在优势: ①彻底清除:降解细胞内病毒基因组,延长治疗窗口; ②快速响应:根据病毒序列信息设计向导RNA,可快速应对新型或变异病毒; ③靶向抑制:靶向病毒基因组的保守序列及多个位点,抵抗病毒逃逸和突变,有效对抗高度变异病毒。 circRNA技术作为CRISPR系统的创新平台的优势: ①circRNA编码Cas蛋白:在体内更持续表达Cas蛋白,实现更持久的抗病毒效果,同时避免了Cas蛋白较大难以递送到细胞内的问题。 ②设计环状向导RNA:避免crRNA被过快降解,提高Cas蛋白的靶向精准性和高效性。 circRNA介导的CRISPR-Cas13抗病毒案例 中国台湾国家卫生研究院余佳益研究团队利用体外合成的circRNA编码内质网靶向的Cas13(erCas13)。将erCas13 circRNA递送到N18细胞内,将在ER中复制和隐藏的正黄病毒(orthoflavivirus)感染率下降至~63%,引入sgRNA后,感染率进一步下降到~45%。相比mRNA,erCas13 circRNA表达更多erCas13,sgRNA介导下同样获得更好的抗乙型脑炎病毒(JEV)活性。 图6 不同处理组的JEV感染情况。 / circRNA抗病毒潜力的应用转化 / circRNA凭借闭环结构的特性,编码和非编码的多功能性,为抗病毒药物开发的开辟了多种途径。 图7 circRNA在抗病毒中的应用[1] 未来我们需要最大限度地发挥circRNA对病毒感染的治疗潜力,并进一步加快抗病毒circRNA的应用转化。吉赛生物凭借4大核心技术平台,提供circRNA新药开发一站式CRO服务,助力开拓circRNA在抗病毒领域的更多应用,并加快临床转化。 参考文献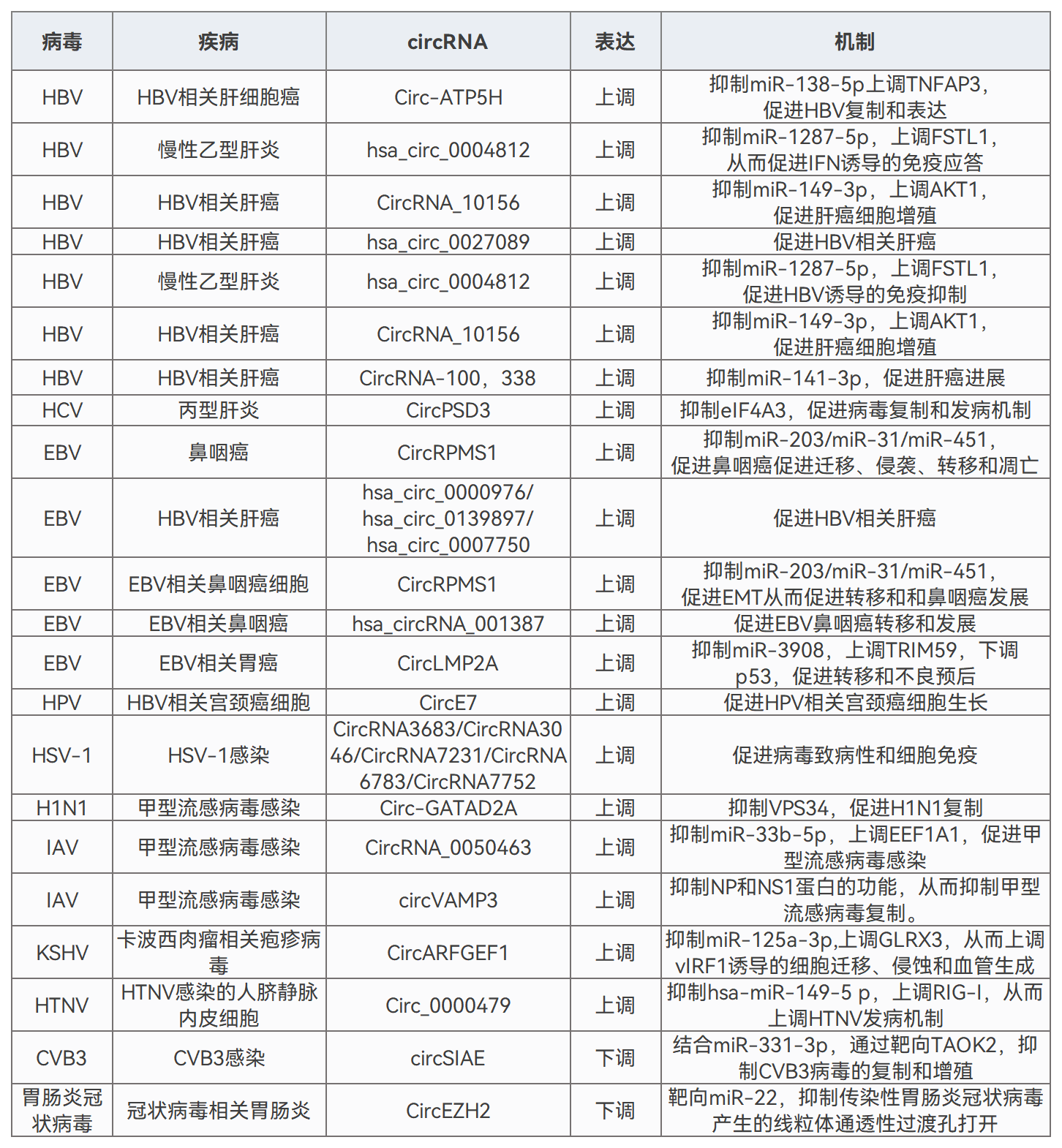

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn