
- 首页
- >
- GENESEED
- >
CAR疗法双革命:从ex vivo到in vivo范式突破,circRNA+LNP开启 “持久表达”新赛道
CAR疗法
驱动生物技术革命与产业格局重构
2025年诺贝尔生理学或医学奖刚刚揭晓,殊荣共同授予免疫学领域的三位研究者——Mary E. Brunkow、Frederick J. Ramsdell与Shimon Sakaguchi,以表彰他们在发现并定义调节性T细胞(Treg细胞)及阐述其在外周免疫耐受中关键作用的卓越贡献。这是继2018年James P. Allison与Tasuku Honjo发现“抑制负免疫调节的癌症疗法”获奖之后,免疫疗法与诺贝尔奖的再度结缘。
诺奖的聚光灯照亮免疫疗法的前沿,而在当前备受关注的免疫疗法中,CAR疗法同样处于舞台中央。基于Treg细胞的深入研究,CAR-Treg疗法为自身免疫性疾病的治疗带来新的曙光;而CAR疗法联合负免疫调节疗法,也在肿瘤免疫治疗领域解锁了新的方向。
CAR疗法正以远超传统药物的迭代速度,快速完成从实验室研究到产业化的跃迁。胞内信号结构域持续迭代,逻辑门控与双特异性CAR设计也在不断突破;细胞类型选择日益丰富,除了成熟应用的CAR-T、CAR-NK与CAR-M,panCAR技术更推动了细胞类型的多样化发展;靶点布局不再局限于CD19这一“独木桥”,曾经“千军万马”聚焦单一靶点的格局被打破,如今各类靶点呈现“百花齐放”的态势;治疗范围从血液肿瘤逐步拓展,同时向实体瘤与自身免疫疾病领域展开积极探索;载体技术实现革新,不仅有传统的基因整合型病毒载体,更发展出LNP-RNA介导的瞬时表达系统;疗法形式上,已上市的ex vivo疗法持续落地,in vivo CAR疗法也已公布最新临床数据。
然而,CAR疗法蓬勃发展的背后,挑战依然严峻:高昂成本与定价会否导致疗法曲高和寡,难以为继?个性化制备工艺如何实现规模化突破?实体瘤治疗效率低的难题何解?治疗有效性与安全性如何兼顾?——这一切,都指向下一代细胞治疗的核心命题。
In Vivo CAR
从“高端定制”到“现货药物”
传统体外(ex vivo)CAR疗法依赖细胞采集-体外细胞改造和扩增-细胞回输一系列复杂的流程,存在较大局限性:
成本高,价格昂贵(近100万人民币/例);
制备困难,周期长,容易错过治疗窗口;
需清淋预处理,创伤大和感染风险高;
副作用大,可能引发细胞因子风暴或神经毒性。
体内(in vivo)CAR疗法则通过直接注射CAR基因载体(如DNA、RNA),在体内完成免疫细胞改造,彻底规避了个体化细胞制备-回输过程,技术核心从体外细胞改造转向基因载体规模化生产,突破了传统技术的局限性,显著提高了治疗可及性和临床适用性:
简化生产流程,降低成本,治疗费用大幅降低;
显著缩短研发和生产周期,实现“现货型药物”;
无需清淋,创伤小,安全性更高;
panCAR技术可在体内重编辑多种免疫细胞。
近两年in vivo CAR-T疗法接连实现重要里程碑:
2024年10月,全球首个进入人体临床试验的in vivo CAR-T疗法INT2104(Interius BioTherapeutics),针对B细胞恶性肿瘤完成首例患者给药。
2025年3月,首例mRNA-LNP介导的in vivo CAR疗法JCXH-213(嘉晨西海)完成临床给药,用于治疗复发/难治性B细胞非霍奇金淋巴瘤。
2025年7月,武汉同济医学院附属协和医院的梅恒教授团队、EsoBiotec团队、普瑞金团队开发的ESO-T01首个临床结果发表于Lancet,展现出积极的临床效果,涵盖了IIT中4例多发性骨髓瘤患者的数据[1]。
随后,2025年9月,虹信生物首次公布了mRNA-LNP介导的in vivo CAR-T疗法HN2301用于系统性红斑狼疮(SLE)治疗的临床数据,其在人体中的有效性和安全性得到初步验证[2]。
circRNA
从基因整合到可控可逆的CAR表达平台
目前已获批的CAR-T疗法普遍依赖γ-逆转录病毒或慢病毒载体对T细胞进行基因改造,以实现高效转导和长期稳定的CAR表达。然而,病毒载体系统存在明显局限:
生产工艺复杂、周期长;
会产生ADA效应,复发后难以二次给药;
整合基因组,存在插入突变和激活癌基因等风险;
不可控、不可逆的长期表达,存在安全隐患。
而LNP-RNA技术突破了传统病毒载体的局限,为开发更安全、经济、高效的体内CAR疗法提供了理想平台:
生产工艺更为简便;
不会整合基因,安全性更高;
瞬时表达,具备可逆、可调控的表达特性。
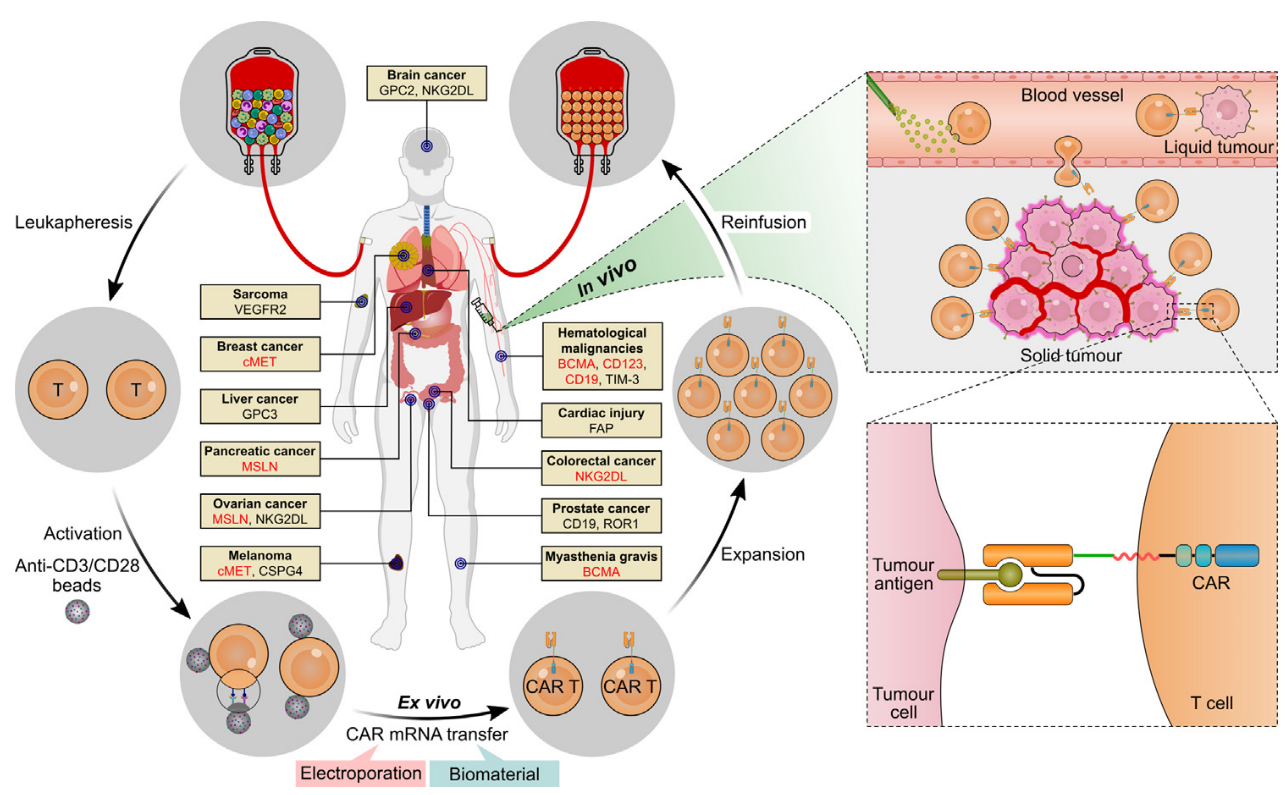
图1 基于mRNA的ex vivo CAR-T涉及多个步骤(左),而in vivo CAR-T免除了复杂的流程(右)[3]。
然而,mRNA技术也存在不可忽视的短板:
短暂表达:mRNA在体内存留时间有限,难以持久表达CAR,可能导致长期疗效不足;
重复给药:为维持疗效,需增加治疗频率,影响治疗便利性;需增加剂量,增加治疗成本和潜在副作用。
基于LNP-mRNA的in vivo CAR疗法取得临床进展的同时,环状RNA(circRNA)介导的in vivo CAR疗法也正迅速兴起。circRNA凭借其独特的共价闭合环状结构,在保留mRNA所有优势的基础上,展现出多项显著优势:
卓越的稳定性:闭环结构可有效抵抗核酸外切酶降解,显著延长半衰期;更强的热稳定性,降低了对冷链的依赖,更便于储存与运输;
持久高效的表达:能在体内实现更长时效、更高水平的CAR蛋白表达,稳定的表达使其生物利用度更高,有望减少治疗频率和剂量,并诱导更强效、更持久的免疫应答;
简化的工艺:闭环结构,无需加帽、加尾、假尿苷修饰等相关原料,有望进一步降低生产成本,提高in vivo CAR疗法的可及性。
这些优势有望使circRNA成为下一代体内CAR治疗的重要突破方向。
靶向性LNP
高效可控的CAR RNA递送系统
精确靶向性、高效率药物递送、良好安全性和耐受性及可规模化生产的递送系统,是在体内CAR细胞成功构建的核心挑战。开发体内CAR-T递送的优化策略可从以下四个维度展开:
① 精确靶向性优化策略:高亲和力与特异性配体或是双特异性或多特异性配体筛选与工程化优化;靶向逻辑门控;
② 高效率递送药物优化策略:LNP组分与配方优化;剂量与给药方案优化;
③ 良好的安全性和耐受性优化策略:最小免疫原性或是引入安全开关;
④ 可规模化生产优化策略:建立严格的质量控制(QC)体系,严格表征LNP关键质量属性如粒径分布和均一性;包封率,靶向性结合效率和取向及效力和安全性测试,形成稳定的模块化生产工艺。
LNP-circRNA
下一代in vivo CAR疗法的新赛道
全球多个研发团队正积极开发基于LNP-circRNA的in vivo CAR疗法,并针对实体瘤、自身免疫疾病、衰老等多种病症进行了充分的临床前概念验证,结果均展现了LNP-circRNA在in vivo CAR疗法应用的无限潜力。
山东大学团队开发了CAR-mLNP+CSR-mLNP/IL-2@gel疗法[2],该疗法利用新型可电离脂质NMS-C9H19并添加甘露糖修饰的巨噬细胞趋向性性LNP(mLNP),递送编码IL-2R-TLR4嵌合信号受体(CSR)和anti-CA9 CAR的circRNA,并设计水凝胶负载缓释mLNP-circRNA和IL-2治疗剂,在体内生成CAR-M,并可控地促进CAR-M的促炎表型。在肾癌小鼠模型中,CAR-mLNP+CSR-mLNP/IL-2@gel治疗重塑了免疫抑制性肿瘤微环境,显著促进肿瘤消退,且具有良好的安全性,展现了肾癌新型疗法的巨大潜力。[4]
北京大学、环码生物及迈威生物团队开发了一种靶向uPAR的体内CAR circRNA疗法。该疗法采用含有新型拟心磷脂磷酰胺(CAMP)脂质的T细胞趋向性LNP,递送编码anti-uPAR CAR的circRNA,显著增强并延长了脾脏和T细胞的CAR表达,在动物模型中显示出治疗肝纤维化和类风湿性关节炎的潜力。研究同时筛选出人源anti-uPAR CAR序列,以推进炎症性衰老等相关疾病的临床转化。[5]
复旦大学联合中科院北京纳米能源与系统研究所团队开发了一种基于LNP-circRNA的in vivo CAR-VAC疗法,利用脾脏靶向的LNP递送anti-HER2-CAR circRNA与HER2 circRNA肿瘤疫苗,在小鼠模型中展现出显著增强的抗肿瘤活性,有效抑制肿瘤生长。[6]
此外,复旦大学团队还开发了靶向CD19的panCAR circRNA疗法,利用一类新型可电离脂质,构建了免疫细胞趋向性的LNP,递送编码anti-CD19 CAR的circRNA。该疗法在小鼠模型中显示出对系统性红斑狼疮(SLE)、哮喘及衰老相关疾病的良好治疗潜力,并在食蟹猴实验中实现了B细胞的完全清除与重建,整体表现出优异的安全性和有效性。[7]
全球药企巨头百时美施贵宝(Bristol Myers Squibb)近日宣布,将以15亿美金现金收购Orbital Therapeutics。这场交易的核心,是Orbital独家的RNA药物平台,及其针对自身免疫病的“下一代in vivo CAR-T疗法”——OTX-201。该疗法利用靶向性LNP递送编码anti-CD19 CAR的circRNA,在非人灵长类动物研究中展现出显著疗效,可实现血液、脾脏及淋巴结中B细胞的完全耗竭,为自身免疫性疾病治疗提供了关键的免疫系统重置基础。目前该疗法已启动IND申报程序,计划于2026年上半年进入临床试验阶段。[8]
Orna公司基于其panCAR™平台,开发用于治疗B细胞介导的自身免疫性疾病(靶向CD19)与B细胞恶性肿瘤(靶向CD19/BCMA)的体内CAR circRNA疗法。该平台采用肝外靶向LNP(无需靶向配体),将表达CAR的circRNA精准递送至疾病相关免疫细胞。CD19 panCAR circRNA疗法在人源化狼疮小鼠模型中表现出优于利妥昔单抗的B细胞清除能力和dsDNA水平下降,并在非人灵长类动物中以低剂量实现持续、稳健的B细胞耗竭。目前该疗法处于临床前验证阶段,预计将于2026年进入临床试验。[9]
CAR疗法的深刻进化
推动着生物制药新时代
circRNA技术开启in vivo CAR疗法第二次浪潮,它绝非对mRNA方案的简单替代:
1. 超越时限,从“瞬时补给”到“持久工厂”:有效抵抗外切酶降解,在细胞内表现出卓越的稳定性,表达持续时间可延长至数周甚至更长,如同一个持续生产的微型蛋白质工厂,有望实现单次给药诱导的长期缓解。
2. 突破成本与剂量限制,成为“可负担的现货药物”:更长的表达时长意味着要达到同等疗效,所需的给药剂量和频率可能显著降低,这不仅进一步减少了潜在副作用,也为大幅降低治疗成本提供了可能。
3. 精准与长效双驱,拓展应用边界:成功地将靶向递送(LNP) 与持久表达(circRNA) 的优势结合,代表了未来发展的一个重要方向。它有望突破现有mRNA方案在治疗持久性和经济性上的天花板,为征服更广泛的癌症类型提供强大的新武器。
总结而言,从ex vivo到in vivo是CAR疗法领域的第一次范式革命,而从线性mRNA到环状RNA,则是在这场革命内部的一次深刻进化。两者共同推动着癌症和自身免疫疾病治疗从一个高度定制化的“手工艺时代”,大步迈向一个标准化、规模化、可负担的“生物制药工业化时代”。
吉赛生物凭借自主知识产权的circRNA技术平台,提供从核心原料到CRDMO服务的全流程解决方案,助力创新药企快速推进in vivo CAR疗法研发。
circRNA创新疗法CRDMO服务
吉赛生物已构建覆盖circRNA药物全链条的技术平台与服务体系——从靶点发现到规模生产,涵盖序列设计、成药性评价、工艺开发、质量研究至GMP生产,形成完整闭环,为circRNA-in vivo CAR疗法开发提供全程护航。
_20251014162139A590.png)

核心酶原料:降本增效的关键
吉赛生物依托自主研发和生产体系,提供一系列circRNA体外合成的高性能核心工具酶,有助于提升circRNA合成效率,进一步降低in vivo CAR药物的生产成本,为药物开发与产业化提供稳定原料支撑。
RNA体外转录 | RNA环化 | 纯化/质控 |
参考资料
[1]Xu J, et al. In-vivo B-cell maturation antigen CAR T-cell therapy for relapsed or refractory multiple myeloma. Lancet. 2025; 406(10500): 228-231.
[2]Wang Q, et al. In Vivo CD19 CAR T-Cell Therapy for Refractory Systemic Lupus Erythematosus. N Engl J Med. 2025.
[3]Wu J, et al. Chimeric antigen receptor therapy meets mRNA technology. Trends Biotechnol. 2024;42(2):228-240.
[4]Jing W, et al. An in situ engineered chimeric IL-2 receptor potentiates the tumoricidal activity of proinflammatory CAR macrophages in renal cell carcinoma. Nat Cancer. 2025 ;6(5):838-853.
[5]Zhang Z, et al. Cardiolipin-mimic lipid nanoparticles without antibody modification delivered senolytic in-vivo CAR-T therapy for inflamm-aging. bioRxiv. 2024.
[6]Wang Y, et al. Synergically enhanced anti-tumor immunity of in vivo panCAR by circRNA vaccine boosting. Cell Rep Med. 2025;6(8):102250.
[7]Wang Y, et al. CircRNA-based, non-integrated, in vivo panCAR-mediated B cell immune resetting in mouse models and non-human primates. bioRxiv. 2025.
[8]https://www.orbitaltx.com/orbital-therapeutics-presents-non-human-primate-data-for-in-vivo-car-t-therapy-with-potential-best-in-class-profile-for-autoimmune-disease/

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn