
- 首页
- >
- GENESEED
- >
斯坦福张元豪团队开发肝外靶向、可调控可预测的GSer-CARTs转运体,高效递送circOVA有效诱导免疫反应并抑制肿瘤生长

2024年5月14日,斯坦福大学的张元豪教授和Wender研究团队在J Am Chem Soc(IF=15.0)上发表了关于RNA递送方法的新研究,题为“Organ- and Cell-Selective Delivery of mRNA In Vivo Using Guanidinylated Serinol Charge-Altering Releasable Transporters”。该论文描述了一种通过电荷抵消动态控制胍离子活动性的新方法,研究团队根据该机制开发了一种肝外靶向、可调控、可预测的GSer-CARTs转运体,实现了circOVA的体内高效递送,并有效诱导免疫反应并抑制肿瘤生长。该研究为器官选择性RNA递送提供了一种新的策略和递送系统,在癌症疫苗开发中具有潜在的应用前景。
RNA药物是一类用于预防、诊断和治疗广泛医学问题的新兴药物,随着针对COVID -19的有效mRNA疫苗的开发,以及针对基因组编辑、癌症免疫治疗、和传染病治疗的临床试验的增加,RNA药物获得了普遍的认可。然而,mRNA疫苗广泛应用面临的重大挑战之一是开发安全、有效和可扩展的递送系统,该系统需要有效地包封极性RNA多聚阴离子,选择性地跨越非极性细胞和器官屏障,并释放RNA进行翻译。尽管mRNA传递系统的开发取得了令人瞩目的进展,但有效并选择性地向器官和细胞递送仍然是一个重大挑战。
脂质纳米颗粒(LNPs)的mRNA递送越来越受重视,临床研究中的LNP−mRNA制剂在静脉注射时对肝脏递送非常有效,在肌肉注射时对局部递送非常有效。然而,将mRNA高效、选择性地递送到其他器官,如肺和淋巴系统,仍然是一个持续的挑战。
最近,研发人员注意力集中在研发有器官和细胞选择性摄取能力的mRNA递送系统上。一种策略是用靶向特定细胞表面受体的配体修饰LNP表面。
另一种策略是设计给药后失去阳离子电荷的mRNA转运体。Chang、Levy、Waymouth和Wender小组曾报道过一类新的寡核苷酸转运体——电荷改变的可释放转运体(CART,Charge-Altering Releasable Transporters),它们是分步经济组装的,可以有效地递送包括mRNA、siRNA、siRNA在内的多种RNA。
绝大多数多阴离子转运体(包括LNPs和CART)的一个关键结构成分是阳离子基团,普遍为质子化或烷基化胺(即铵离子),其作用是静电结合带负电荷的寡核苷酸以形成纳米颗粒复合物。与基于质子胺的递送系统相比,以两亲性富含胍的寡碳酸转运体形式出现的短链阳离子胍基团可以在体外以高达 90% 的效率复合、保护和递送 siRNA。与铵基团不同,胍基团与带负电荷的双酸盐氧阴离子形成相对较强的双酸氢键和静电结合,特别是细胞摄取涉及的磷脂或RNA络合所需的多磷酸盐。然而,胍基团在复合更长的聚阴离子(如mRNA)存在问题。虽然能有效进行 mRNA 络合和进入细胞,但 mRNA 释放失败,这可能是由于寡聚阳离子胍基团与 mRNA 磷酸盐更强和持久的静电结合。
为解决这个问题,斯坦福大学的张元豪教授和Wender研究团队开发了用于 RNA 递送的含胍转运体的第一个电荷消除示例,其设计目的是将胍基团降解为中性副产物,从而实现高效的 mRNA 释放和翻译。
首先,研究团队通过制备了一系列模型化合物,研究胍基在丝氨酸醇支架上的电荷改变。结果揭示了一种新的机制,胍-碳酸盐环化级联导致电荷抵消,在低pH下与磷酸盐强结合的胍基团在高pH下经历电荷抵消,从而消除其静电磷酸盐结合。
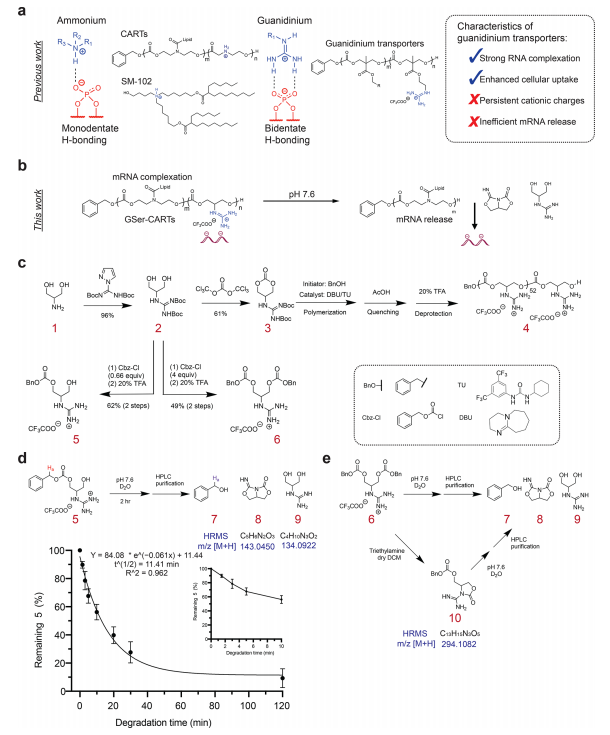
图1. GSer基序的合成及其在生理pH下的降解。
为研究这种独特的基于胍的电荷消除递送系统,研究中合成了九种不同脂质类型、聚合物骨架和聚合度(DP)的GSer-CARTs。研究团队对GSer-CARTs/mRNA复合物的生物物理特性进行了表征,表明该复合物在酸性配方下保持稳定,但在生理pH值下迅速降解。所得到的复合物在体外能有效转染细胞。
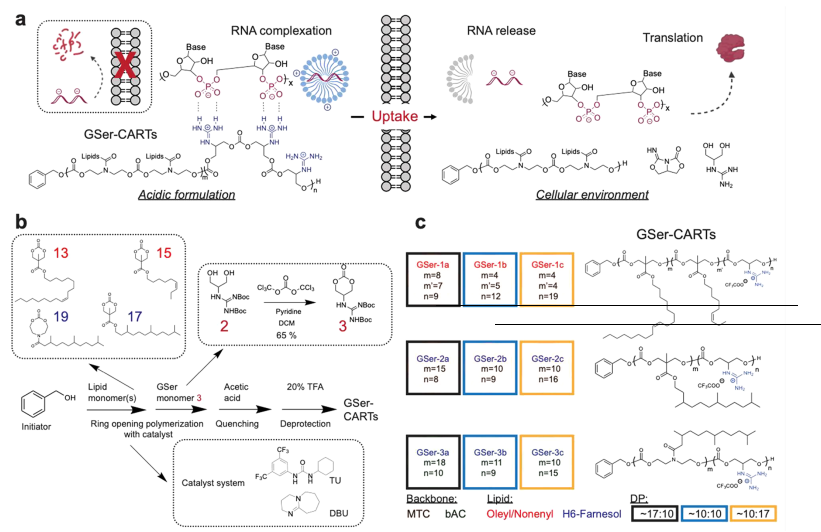
图2. GSer-CART的合成、GSer-CART/mRNA复合物的生物物理特性及其体外递送效率评价。
研究团队经体外验证,筛选出的最有效递送的6种包封荧光素酶mRNA的GSer-CARTs,并通过静脉注射到BALB/c小鼠体内。结果表明,不同结构的GSer-CART有不同器官倾向性。而同一种GSer-CART经调整电荷比后,其器官倾向性改变。其中,高电荷比有利于肺传递,低电荷比有利于脾传递,表明调整电荷比可以控制GSer-CART的器官倾向性。与FDA批准的LNP制剂相比, GSer-CART在肝脏表达最少,且其倾向性与静脉注射的不同途径无关。
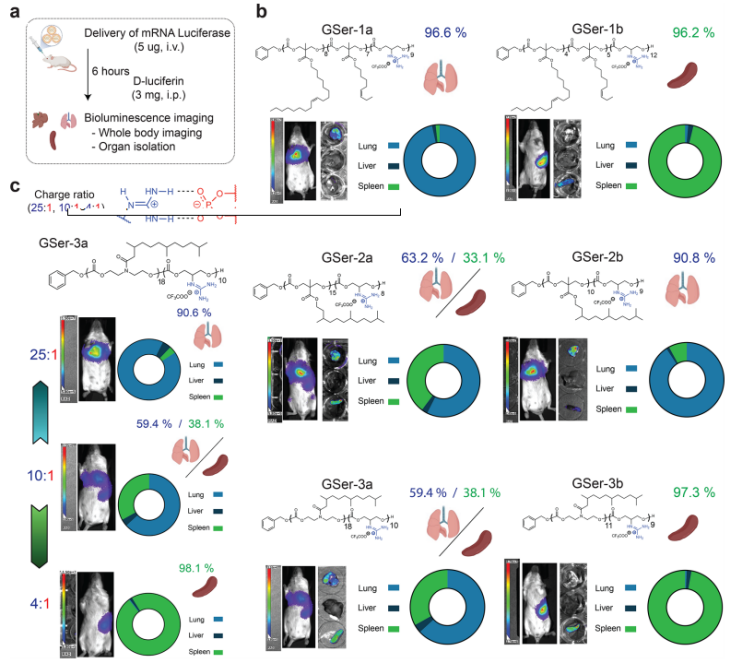
图3. GSer-CART在体内表现出可调节的器官趋向性。
研究团队把小鼠血浆与肺倾向和脾倾向配方的GSerCART/mRNA复合物孵育,发现不同的电荷比改变了生理pH下GSer-CART/mRNA复合物的表面电荷,这种变化与器官趋向性有关;通过监测小鼠血浆孵育后纳米颗粒的大小,结合PCA分析,表明血浆中培养的复合物大小是与器官向性相关的主要因素。
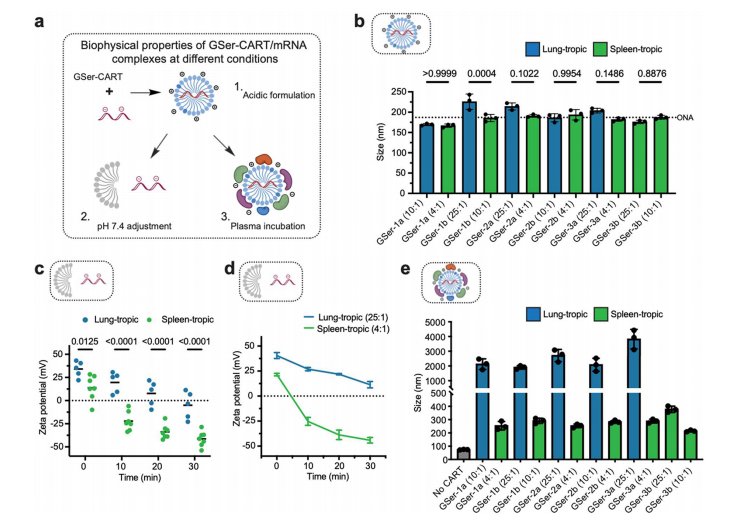
图4. 嗜肺性和嗜脾性GSer-CART/mRNA复合物具有不同的生物物理特性。
除了研究器官选择性外,该研究用Cre重组酶小鼠模型(Ai14小鼠)研究了肺倾向性配方(GSer-3a)和脾脏倾向性配方(GSer-3b)递送的细胞群类型,结果不但证明了这两种配方有效的器官倾向性,能递送不同的mRNA;还表明了GSer-3a主要倾向内皮细胞递送,GSer-3b主要倾向巨噬细胞递送。GSer-CARTs对特定细胞的优异选择性在多种生物医学应用中可有重要用途。
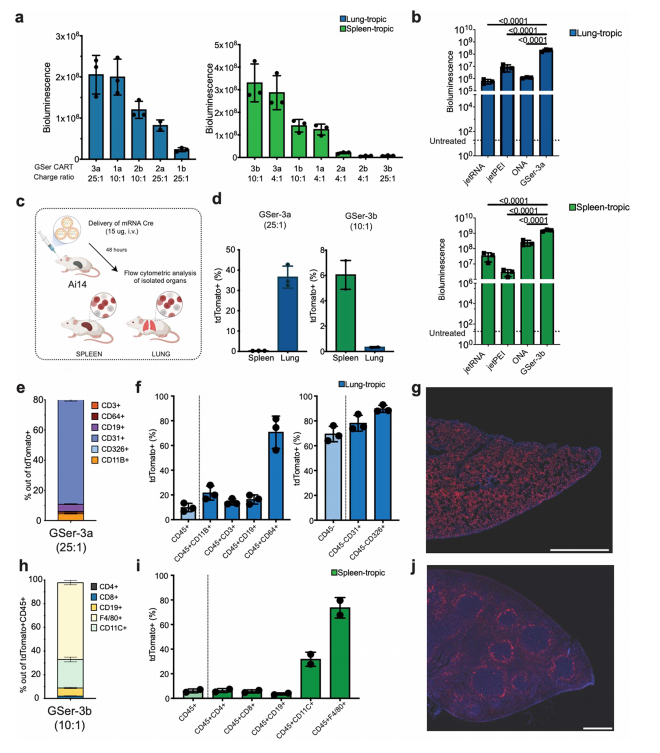
图5.肺倾向性和脾倾向性GSer-CART/mRNA复合物在肺内皮细胞和脾巨噬细胞中优先转染,有效递送mRNA。
与mRNA相比,环状RNA(circRNA)代表了一类新的RNA,其具有更高的稳定性和更持久的蛋白质表达。以往的研究表明,环状RNA具有独特的活性,如可诱导强烈的T细胞免疫,并在用CART包封circRNA后,腹腔注射的研究中诱导了肿瘤的清除。研究团队体外制备了编码鸡卵白蛋白的circRNA(circOVA),并分别用GSer-3a和GSer-3b两种配方进行包封,然后静脉注射到小鼠体内。结果表明,GSer-3b/circOVA能诱导强烈的T细胞反应;在C57BL/6J小鼠皮下成瘤模型中,GSer-3a和GSer-3b两种转运体配方均能抑制肿瘤生长。研究团队还通过血液代谢物和炎性细胞因子分析证明了GSer-CART/mRNA复合物是无毒的,并且复合物可以在不同温度下储存,具有不同程度的稳定性。这些结果共同证明了GSer-CARTs对mRNA递送的功效、选择性、多功能性、耐受性和稳定性。
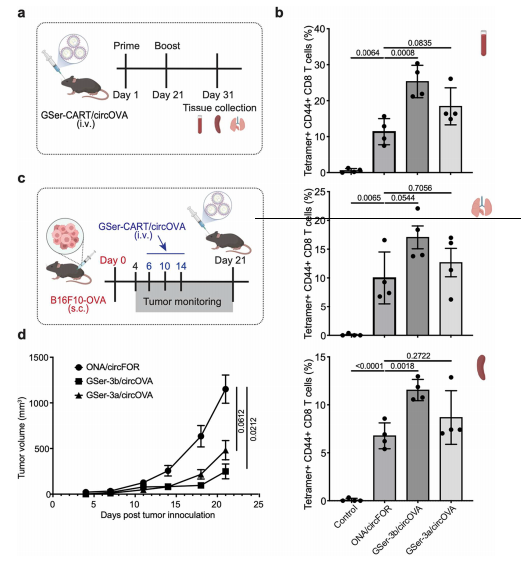
图6. GSer-CART/circOVA复合物可引起较强的抗肿瘤反应,抑制肿瘤生长。
总结
虽然绝大多数RNA递送系统基于可质子化胺(铵阳离子),但胍阳离子在肽和非肽分子转运蛋白的细胞穿透性能中具有显著特征,并且已知有助于细胞摄取。然而,它们用于聚阴离子递送的用途受到限制,部分原因是它们强烈的聚阴离子络合物抑制释放。该研究用一种新型的基于胍的递送系统(GSer-CARTs)解决这一限制,其中阳离子胍基团在生理pH下动态转化为中性副产物,从而能够释放其聚阴离子包含物。这一新的电荷消除过程为更广泛地使用胍阳离子代替铵离子作为递送组分打开了大门。
值得注意的是,GSer-CART以可调控和可预测的方式向肝外器官(肺高达97%,脾高达98%)进行高效和选择性的mRNA递送,这是未来CART和潜在的其他递送系统的一种重要策略。通过递送circOVA在癌症疫苗接种中的成功应用表明了GSer-CARTs的翻译潜力,circOVA显示了诱导细胞毒性、抗原特异性T细胞的强大能力以及肿瘤生长抑制力。GSer-CART/circOVA癌症疫苗的概念验证开发突出了GSer-CART的临床潜力,表明其在各种生物医学研究和治疗环境中具有更广泛的应用。
研究中应用的免疫抗原类circRNA是肿瘤免疫疗法的理想研究工具。卵清蛋白 (OVA) 是丝状蛋白超家族的一员,是在蛋清中发现的主要糖蛋白。是一种常用的免疫和生化研究抗原,是一种已建立的气道高反应性模型过敏原,也是一种肿瘤抗原,可激活细胞免疫和体液免疫,从而抑制肿瘤生长甚至清除肿瘤。
正如文中所言,与mRNA等线性RNA相比,circRNA的闭环结构使其在机体中存在的半衰期大幅延长,这种稳定的结构对于功能性蛋白/多肽的持续表达极为有利。
依托十多年circRNA领域的专注研发及创新探索,吉赛生物具备circPure®和circPrecise®两大原研专利环化技术,能实现环化效率高、完整性高、纯度高、翻译效率高、品质好的circRNA量产。此外,吉赛生物还可提供包括肿瘤抗原OVA在内多个系列的预制现货产品。产品采用独立自主知识产权技术制备,可作为实验探索的阳性对照,用于翻译表达验证、转染递送评估、工艺流程优化等领域,赋能下一代RNA疗法。
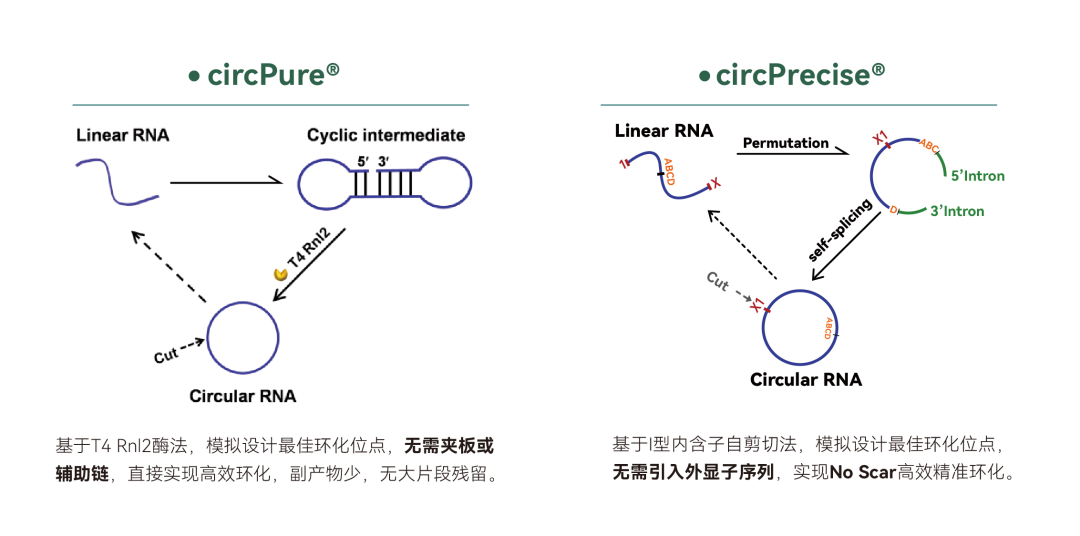
吉赛生物circRNA体外制备策略
参考文献
[1] Li Z, Amaya L, Ee A, Wang SK, Ranjan A, Waymouth RM, Chang HY, Wender PA. Organ- and Cell-Selective Delivery of mRNA In Vivo Using Guanidinylated Serinol Charge-Altering Releasable Transporters. J Am Chem Soc. 2024 May 14. doi: 10.1021/jacs.4c02704. Epub ahead of print. PMID: 38743019.

广州吉赛生物科技股份有限公司(以下简称"吉赛生物")成立于2010年6月,是一家专注于circRNA技术研究和产业化开发的高新技术企业。吉赛生物自2014年起,聚焦环状RNA细分领域,持续深耕近十年,具备深厚的原创技术积淀。团队拥有微生物学、分子生物学、生物信息学、生物制药等多领域专业人才,可为高校、医院、研究院等科研单位提供circRNA研究整体解决方案;拥有RNA环化技术自主知识产权,建立了circRNA序列设计平台、circRNA生产制备平台、circRNA纯化平台、circRNA质控平台、核心工具酶生产平台,可为药物研发企业提供circRNA CRO服务和工具酶产品。

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn