
- 首页
- >
- GENESEED
- >
编码还是非编码,这是个问题
经典的中心法则只是基因组表达功能分子的众多机制之一。基因组DNA普遍被转录,但只有其中小部分转录成的mRNA,翻译成约2万个蛋白质;其余的大部分不是“垃圾DNA”,而是被转录成非编码RNA(ncRNA),作为基因表达的复杂调节器,与蛋白质共同控制胚胎发育,维持生理状态,决定生物体复杂性,影响遗传性和非遗传性疾病的发生发展。
管家ncRNA
●核糖体RNA(rRNAs)、转移RNA(tRNAs)位于细胞质中,是蛋白质翻译机制的核心组成部分;
●小核RNA(snRNA)、小核仁RNA(snoRNAs)位于细胞核。snRNA是剪接体的RNA成分,snoRNAs是小核仁核糖核蛋白颗粒(snoRNPs)的RNA成分,其通过核苷修饰(主要是甲基化和假尿嘧啶化)负责pre-rRNA的成熟。
调控性ncRNA
●短ncRNA(<200 nt):PIWI互作RNA和microRNA(miRNA)。miRNA(2024年诺奖赢家)可通过诱导沉默复合物(miRISC)靶向特定RNA降解,抑制基因表达。某些miRNA前体也可被翻译产生功能肽。
●长ncRNAs(≥500 nt):长基因间非编码RNA(lincRNAs)、假基因RNA(PG)、天然反义转录物(NAT)和环状RNA(circRNA),可作为信号、向导、诱饵或支架,也可翻译功能肽或蛋白质,调控基因表达。
基因组可广泛转录的研究风潮还盛,基因组广泛翻译的研究又在学术界掀起新的浪潮。随着ncRNA及mRNA非编码区域的可翻译性陆续被发现,编码与非编码基因的绝对二元论已经过时,因为双功能基因既可表达编码产物,也可表达非编码产物。
近日,Cell Research期刊上发表了一篇综述,题为:Coding,or non-coding,that is the question。该综述在基因表达和分子机制方面讨论了双功能基因的复杂转录本,并强调了利用这种复杂性开发抗癌疗法的机遇和挑战。

一、双功能基因座表达mRNA和ncRNA
有些基因可互斥或共存的方式表达mRNA和ncRNA,因而既是编码,也是非编码的(图1)。这些基因座被定义为“杂交”或“双功能”的。
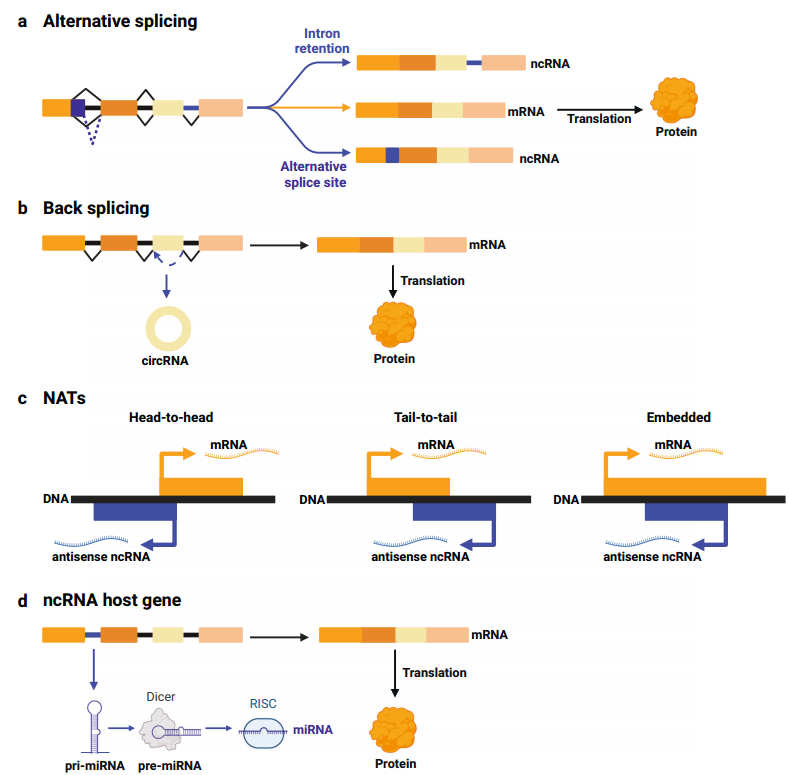
图1双功能基因座表达mRNA和ncRNA。
(1)mRNA和ncRNA的表达取决于外显子拼接
可变剪接(AS)使同一基因座可表达多个转录本,从而丰富转录组(蛋白质组)。有些基因座经历可变剪接,表达编码和非编码转录物(图1a),也有基因座通过反向剪接表达线性编码mRNA和非编码circRNA(图1b),且两种形式都可在癌症中发挥重要作用。
(2)正义mRNA和反义ncRNA的表达
在癌症中,有许多的基因座从两条DNA链转录,最终表达一个正义编码mRNA和一个反义非编码RNA,即NAT(图1c)。
(3)来自外显子的mRNA和来自同一pre-mRNA内含子ncRNA的表达
双功能基因座中,外显子转录成可翻译的mRNA,而内含子转录成ncRNA发挥非编码功能。这种ncRNA被称为“基因内的”,所在的编码基因被称为“宿主基因”。
这种表达方式在miRNA中很常见(图1d),很多miRNA基因位于编码蛋白质基因的内含子,可具有独立的启动子,形成独立的转录单位,但更多是从宿主基因的启动子开始,产生双功能的pre-mRNA:外显子拼接成为mRNA,内含子的pri-miRNA进一步加工成成熟的miRNA。因此,miRNA和宿主基因在调控通路中共同表达和参与。
二、双功能mRNA也发挥非编码功能
mRNA是蛋白质编码RNA,其主要命运是从细胞核输出到细胞质,然后被翻译成蛋白质。然而,mRNA也可发挥非编码功能。(图2)
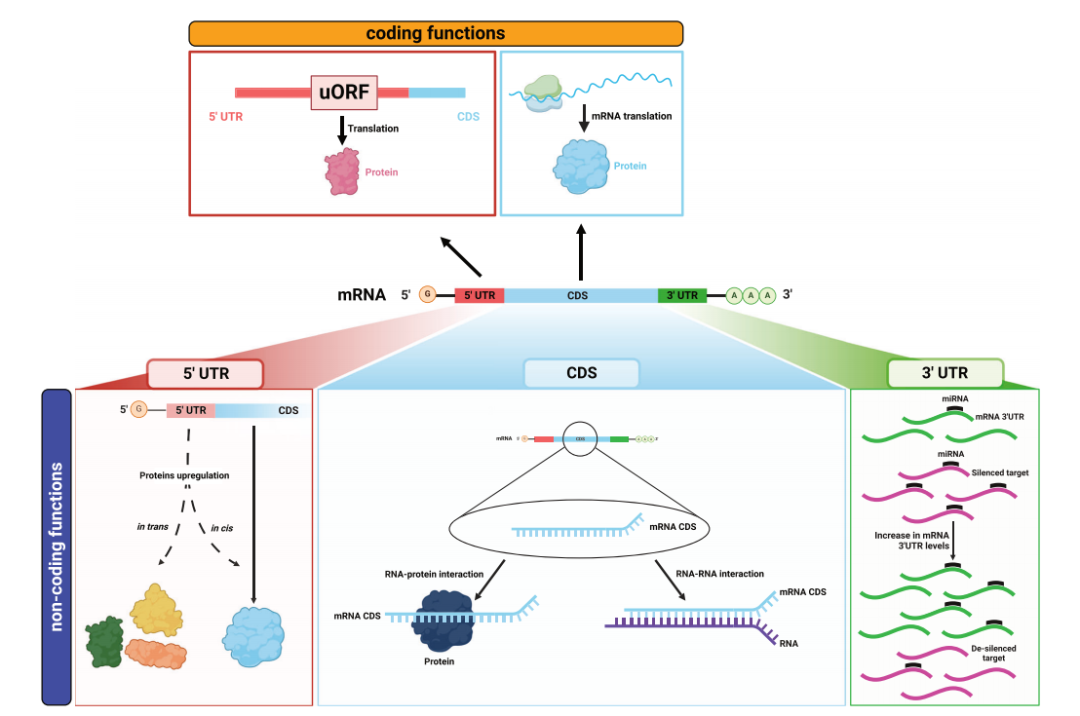
图2双功能mRNA具有编码功能和非编码功能。
(1)5'UTR发挥非编码功能
例如,原癌基因c-MYC的P0转录本5’UTR可导致凋亡细胞死亡增加,可能是由于直接或间接通过RBP与P0-P2 RNA顺式相互作用,影响c-MYC2(p64)蛋白异构体的翻译。[1]
(2)CDS具有非编码功能
CDS是mRNA中注定要被翻译的区域,但有些CDS也发挥非编码功能。例如,DNA损伤传感器ATM使MDM2的Ser395位点磷酸化,可有利于其与抑瘤蛋白p53 mRNA CDS特定序列互作,促进p53 mRNA的翻译。[2-4]
(3)3'UTR发挥非编码功能
3'UTR是基因表达的转录后调控元件,具有顺式和反式两种功能。顺式功能主要与编码相关,涉及mRNA的稳定性、定位和翻译的调节;反式功能是发挥其非编码功能的机制,在mRNA处作为miRNA海绵,即ceRNA机制。
三、双功能ncRNA也发挥编码功能
在过去的几年里,polysome profiling、Ribo-seq和质谱等分析已提供不少证据,ncRNAs可含有ORF,且能翻译成ncRNA编码的肽(ncPEP)。(图3)
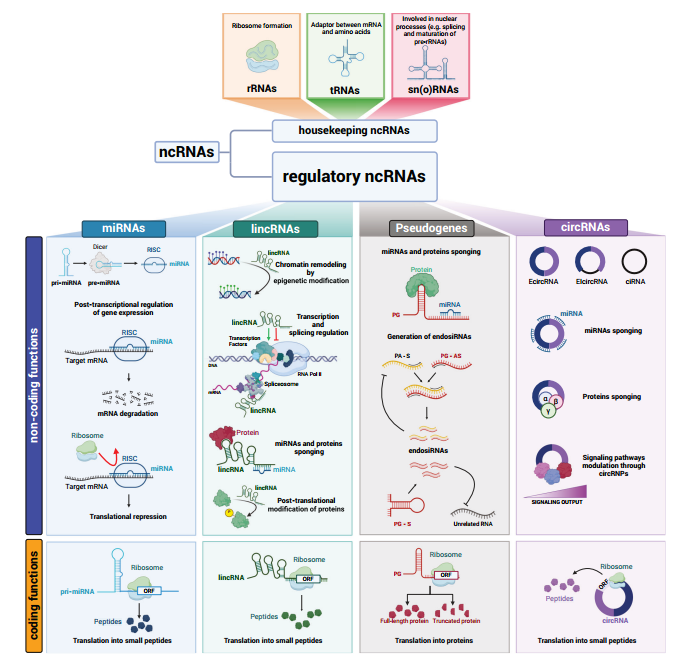
图3双功能ncRNA发挥非编码功能和编码功能。
(1)Pri-miRNA的翻译
miR-200a和miR-200b的pri-miRNA中短ORF存在,其编码肽可抑制迁移和EMT。[5]
(2)lincRNA的翻译
一些lincRNA含有ORF,可编码短肽。例如,LINC00665在大多数情况下,是一种致癌lincRNA,作为20多种miRNA的ceRNA,以及结合染色质重塑因子和调控转录,发挥非编码活性。而在三阴性乳腺癌中,它可表达52 aa的肽(CIP2A-BP),抑制TNBC细胞的迁移和侵袭。[6,7]
(3)PG的翻译
存在数十种假基因蛋白,它们大多由加工过的假基因表达,与亲本基因不共享相同的启动子。
(4)circRNA的翻译
circRNA的翻译也依赖于多聚核糖体,但在没有5’帽和3’polyA尾的情况下,翻译不依赖于帽结构。circRNA的翻译的三个主要机制:
①依赖于内部核糖体进入位点(IRES),可直接招募核糖体启动翻译。
②由N6-甲基腺苷(m6A)介导。至少13%的circRNA携带m6A修饰,并且每个circRNA只需一个修饰就足以促进m6A读取器YTHDF3以及eIF3A和eIF4s(A,B,G2)翻译起始因子的招募。
③当circRNA含有ATG而不含有终止密码子时,会发生滚动翻译,直到被称为-1程序性核糖体移框(-1 PRF)介导的脱框停止密码子(OSC)的机制中断。
四、双功能基因研究技术
(1)双功能基因转录研究
Nanopore全长转录组测序:无需打断RNA,无需拼接,可获得5’到3’全长转录本序列及其表达信息,在检测可变剪接(反向剪接)、融合基因、新基因预测等具有绝对优势,有利于发现双功能基因复杂转录本的发现。
ATAC-seq:通过转座酶对开放的核染色质区域进行切割,获得基因组中所有活跃转录的调控序列,通过生信分析,可挖掘潜在转录起始位点、增强子、沉默子等调控元件及相应的转录因子,有利于发现双功能基因,并研究其复杂的转录机制。
ChIP:通过超声或酶处理将染色质随机切割,利用特异性抗体对目的蛋白相结合的DNA片段进行免疫沉淀,提取目的DNA片断进行qPCR或测序分析,可针对性研究双功能基因的转录调控因子。
(2)非编码功能研究
ncRNA在生物体中可作为信号、向导、诱饵或支架等,影响核组织和基因组完整性、表观遗传修饰的染色质重塑、转录、RNA剪接和加工、mRNA稳定性和翻译、蛋白质翻译后修饰(如磷酸化)、亚细胞定位和活性,从而调控基因的表达。
ncRNA在发挥作用过程中大多数涉及与其它分子(蛋白质、DNA、其它类型的RNA)相互作用,因此,常用到以RNA为中心的分子互作研究技术,如RIP、RNA pull-down、荧光素酶报告检测技术等。此外,ncRNA的功能获得和丧失研究广泛应用到RNA过表达和敲低等技术。
(3)潜在编码RNA翻译研究
ncRNA或mRNA非CDS序列的翻译,尤其是circRNA的翻译陆续被报道,其翻译产物对癌症等疾病发挥重要作用,因此成为了新的研究热点。
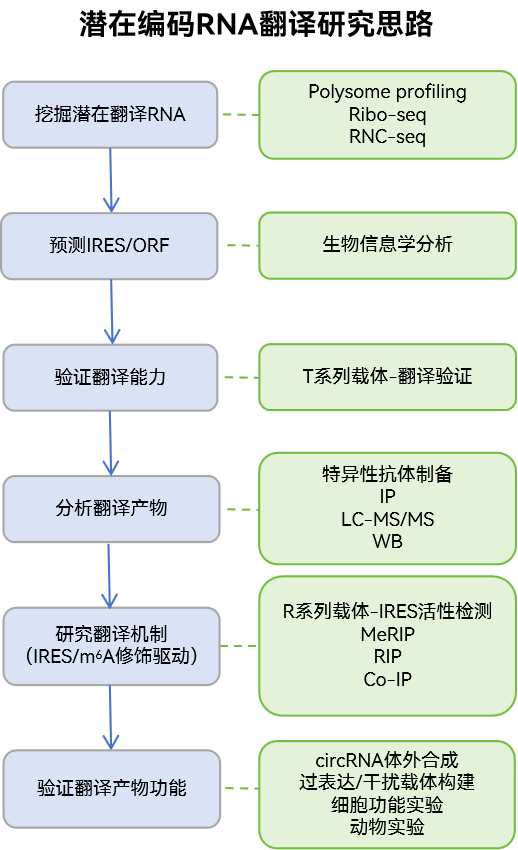
*吉赛生物可提供以上相关研究技术服务及产品。
总结
基因组的复杂性远超编码蛋白质的遗传单位的简单组织。蛋白质是细胞和有机体结构的基石,但众多的非编码RNA也起重要作用,标准CDS外的序列也可编码各种长度的肽。编码和非编码产物功能和翻译机制调控的研究,对理解基因组中的多元化遗传单位是必不可少的。
双功能基因分类应独立于仅编码基因和仅非编码基因。然而,双功能基因分类需要更多的验证和研究。在基于这些基因的疗法开发中,需额外注意不同转录物发挥的功能,以免导致副作用或加重病情。基因组的广泛转录和翻译正为前所未有的科研发现、药物开发和疾病治疗铺平道路。
原文链接
https://pmc.ncbi.nlm.nih.gov/articles/PMC11369213/
参考文献
[1]Blume,S.et al.Inhibition of tumorigenicity by the 5′-untranslated RNA of the human c-myc P0 transcript.Exp.Cell Res.288,131–142(2003).
[2]Candeias,M.M.et al.p53 mRNA controls p53 activity by managing Mdm2 functions.Nat.Cell Biol.10,1098–1105(2008).
[3]Naski,N.et al.The p53 mRNA-Mdm2 interaction.Cell Cycle 8,31–34(2009).
[4]Gajjar,M.et al.The p53 mRNA-Mdm2 interaction controls Mdm2 nuclear trafficking and is required for p53 activation following DNA damage.Cancer Cell.21,25–35(2012).
[5]Fang,J.,Morsalin,S.,Rao,V.N.,Reddy,E.&Shyam,P.Decoding of non-coding DNA and non-coding RNA:pri-micro RNA-encoded novel peptides regulate migration of cancer cells.J.Pharm.Sci.Pharm.3,23–27(2017).
[6]Huang,X.et al.Circular RNA AKT3 upregulates PIK3R1 to enhance cisplatin resistance in gastric cancer via miR-198 suppression.Mol.Cancer 18,71(2019).
[7]Guo,B.et al.Micropeptide CIP2A-BP encoded by LINC00665 inhibits triplenegative breast cancer progression.EMBO J.39,e102190(2020).

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn