
- 首页
- >
- GENESEED
- >
关于RIP技术,你想知道的都在这儿 ↓ ↓ ↓(附实验操作视频)
蛋白-RNA互作
基因表达调控的核心环节
蛋白质和RNA可以通过精确的分子识别(基于特定序列和结构)进行相互作用,这种相互作用是动态且高度调控的,是基因表达调控网络的核心环节。
RNA结合蛋白(RBP)参与几乎所有涉及RNA的核心过程,包括RNA转录、加工、修饰、定位、稳定性、翻译、功能执行以及降解;同时RNA-蛋白互作也参与调控蛋白定位、功能执行、修饰及各类复合物的形成。
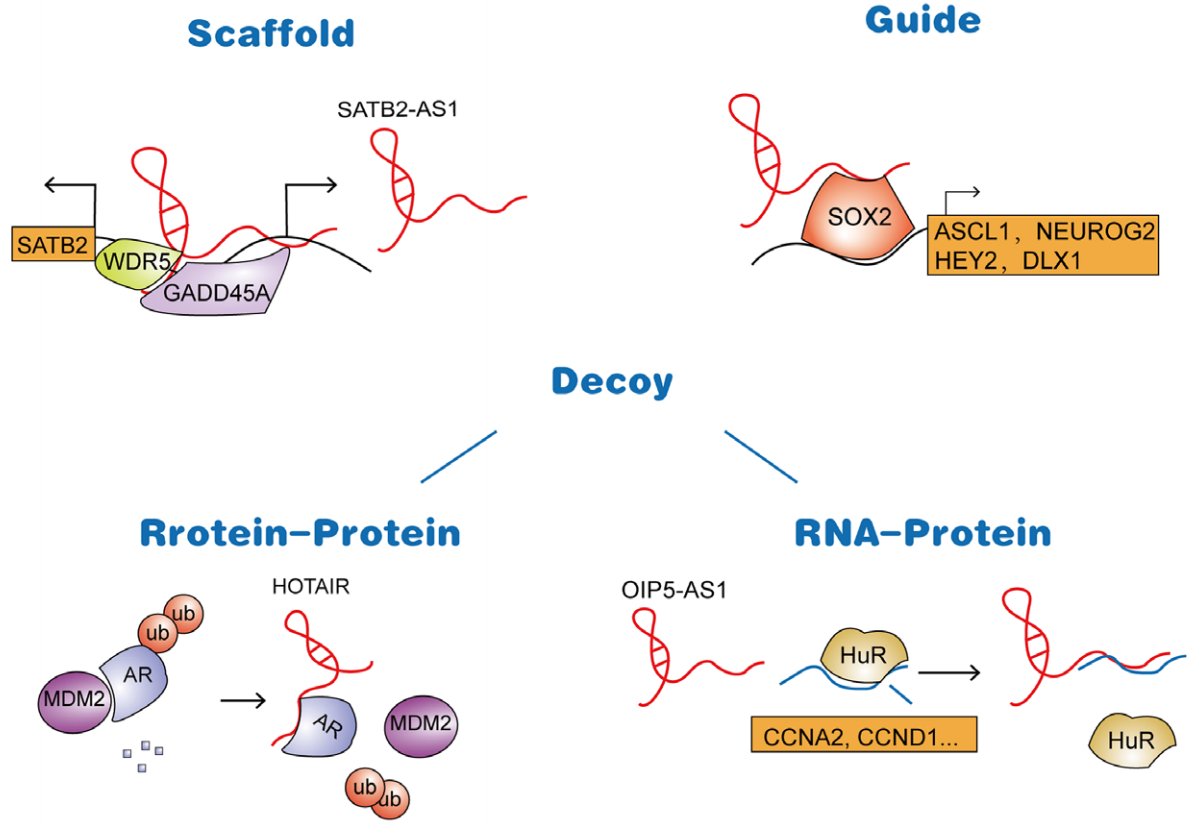
图1 ncRNA(非编码RNA)可通过作为蛋白支架、蛋白与其它分子结合的引导物、蛋白诱饵(竞争性结合蛋白),影响RBP与其它分子互作;或通过影响蛋白修饰相关复合体作用,调控RBP的翻译后修饰。[1]
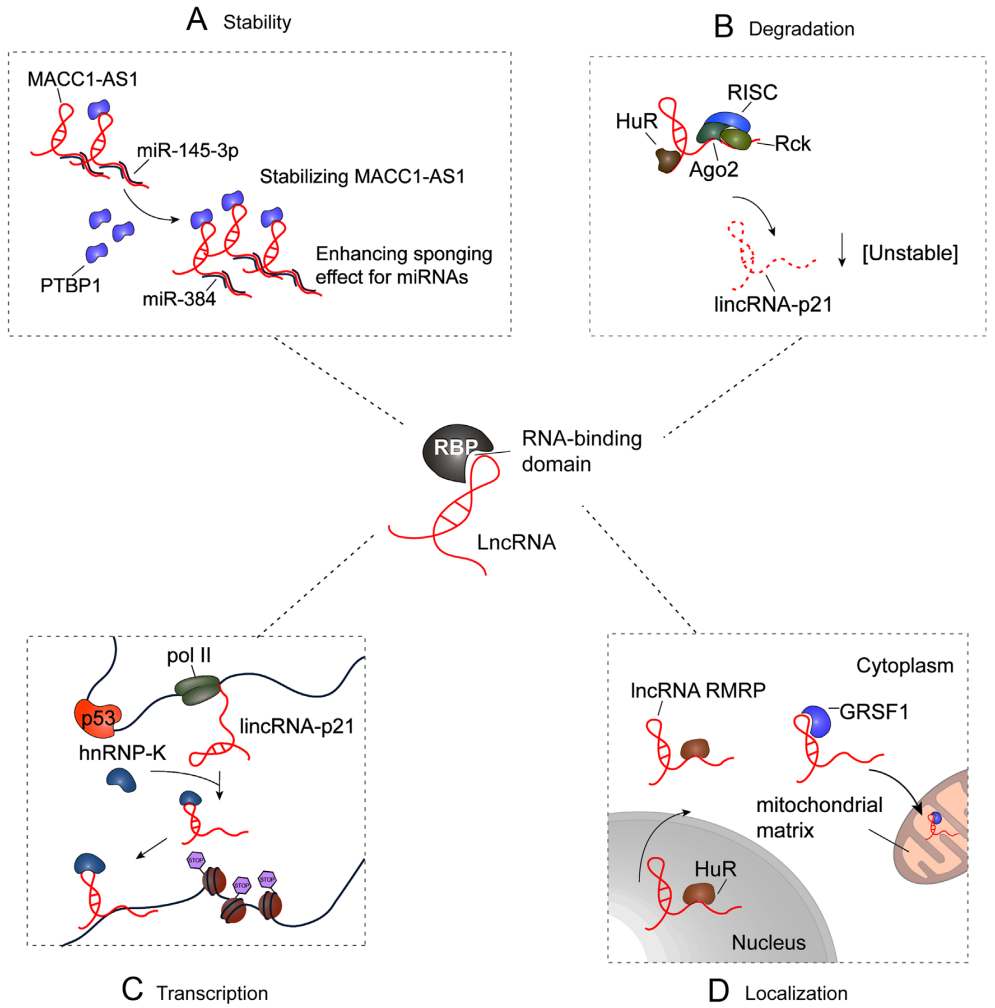
图2 RBP调控ncRNA的功能,如稳定性、降解、协同转录调控、定位。[1]
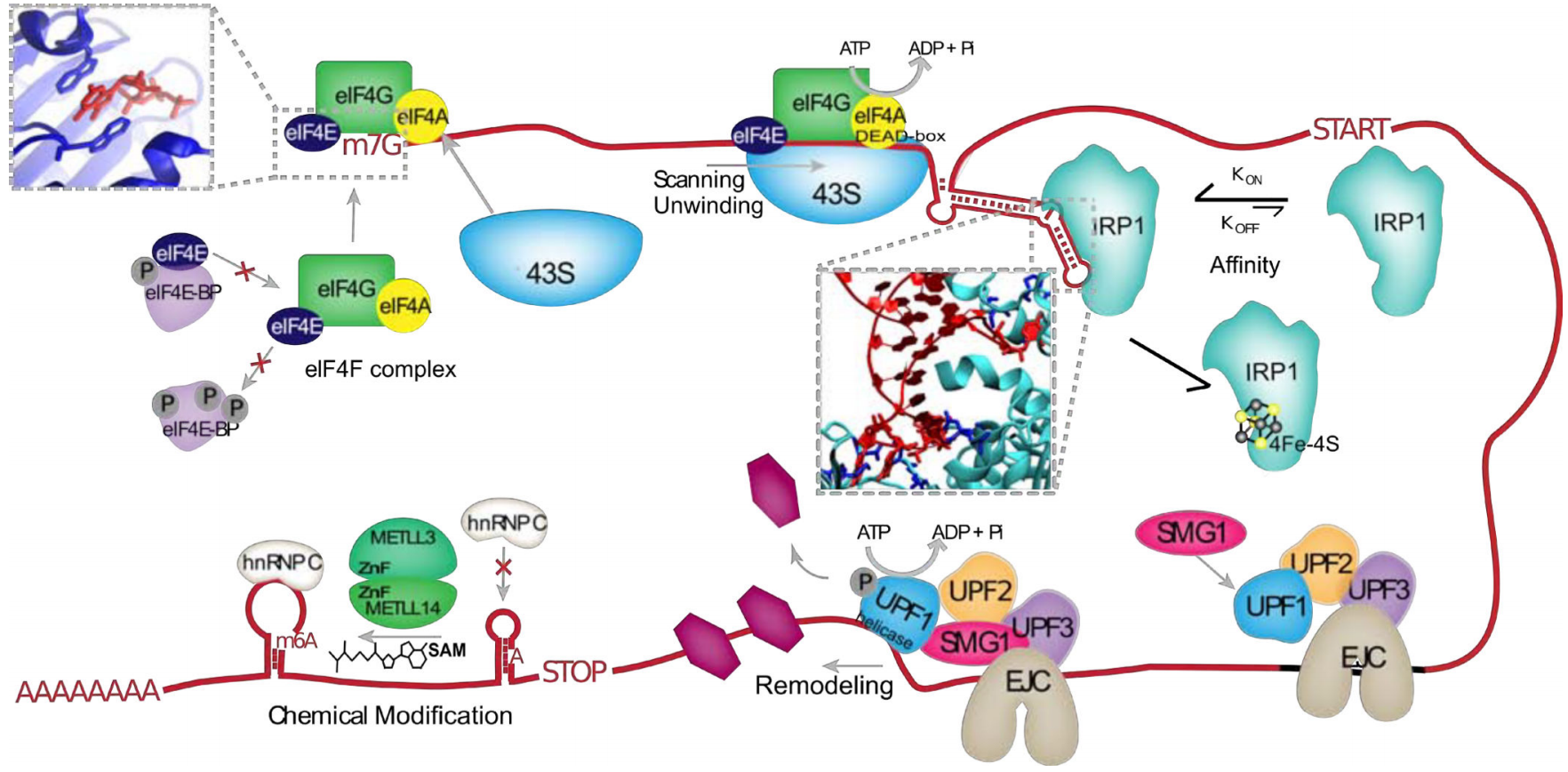
图3 RBP与mRNA相互作用,调控mRNA翻译起始(如eIF4F复合物、IRP蛋白)、剪接(如EJC)、RNA修饰(如甲基化酶、去甲基化酶、甲基化阅读蛋白)。[2]
RIP技术
蛋白-RNA互作分析的重要手段
RIP(RNA免疫共沉淀)是分析细胞内蛋白与RNA相互作用最常用的技术之一,利用目标蛋白的抗体,沉淀目的蛋白及其结合的RNA,纯化后的RNA可进行RT-qPCR、Microarray或高通量测序分析。
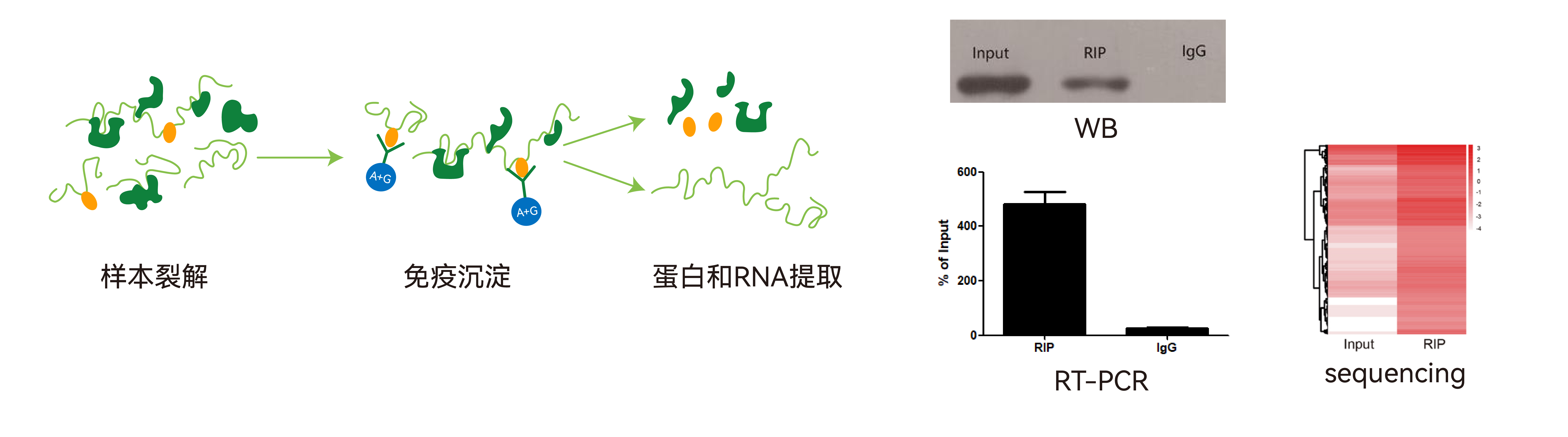
RIP技术可用于探索目标蛋白结合的RNA,研究不同条件下蛋白-RNA互作情况,分析目标RNA是否涉及目标蛋白介导的相关生命过程。
吉赛RIP试剂盒
蛋白-RNA互作分析的必备利器
RIP技术涉及特定的试剂和多种缓冲液,因此要高效完成RIP实验,必备一款好用的试剂盒。吉赛生物RIP试剂盒,持续多年畅销,深受众多实验室青睐,经久信赖,口碑之选!
吉赛优势
①稳定可靠:体系稳定,捕获效率高,重复性高;
②成分完整:含RIP实验所需的全套试剂,包括阴性对照IgG及柱式RNA提取试剂;
③高效便捷:实验时长短至5 h;
④样本需求少:仅需1×107细胞或0.1 g组织;
⑤流程严谨:有详细的目的蛋白富集验证步骤。
吉赛RIP试剂盒操作流程
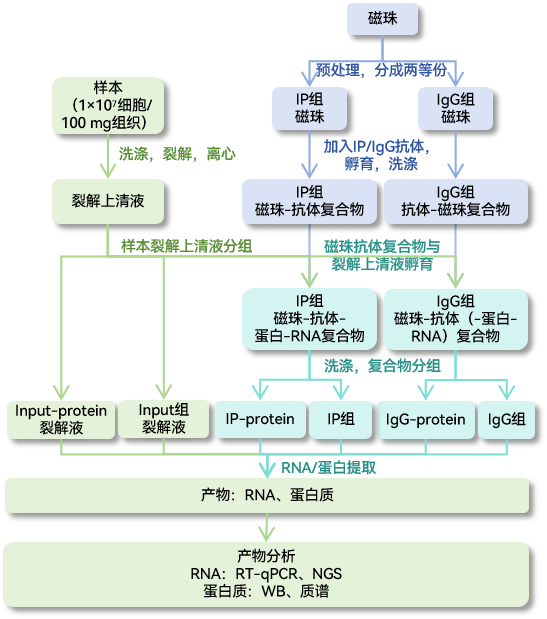
吉赛RIP试剂盒操作视频

以下总结了伙伴们在使用吉赛RIP试剂盒过程中的高频问题和解答,帮助大家轻松、高效、准确分析蛋白-RNA互作!
RIP实验准备相关Q&A
Q:RIP实验需要准备哪些仪器?
A:匀浆器(组织样本用,细胞样本忽略)、移液枪、涡旋器、低温离心机、冰盒、旋转培养器(可进行垂直圆周运动的)、磁力架(用于吸附溶液中的磁珠)。
Q:RIP试剂盒可以用几次?
A:一次标准的RIP实验含Input组、IP组(实验组)及IgG组(阴性对照),IgG组与IP组是平行的两个IP实验,均消耗1T试剂量。因此一次(一个样本)RIP实验要消耗2T试剂量,即吉赛RIP试剂盒12T可做6次标准的RIP实验(样本);24T可做12次标准的RIP实验(样本)。
Q:RIP试剂盒能不能分析RNA修饰?
A:不可以,RIP试剂盒是用于分析蛋白和RNA的相互作用,不能用于分析RNA修饰(乙酰化、甲基化等);但可以用于分析RNA修饰相关蛋白(如Writer、Eraser、Reader)与RNA的互作。
Q:RIP和m6A-RIP(MeRIP)有什么区别?RIP试剂盒可以用于MeRIP实验吗?
A:RIP和MeRIP原理和步骤均不相同,因此不建议RIP试剂盒用于MeRIP实验。
RIP利用抗体结合蛋白,下拉蛋白-RNA复合物,无需RNA预提取和片段化步骤。MeRIP利用anti-m6A抗体直接结合RNA上的m6A修饰并下拉RNA;MeRIP为提高下拉效率,通常需要先提取RNA;为确定具体修饰的片段,一般需要先将RNA片段化。
Q:想做miRNA-RNA互作验证,可以如何设计RIP实验?
A:如果想验证ceRNA机制,可以用anti-Ago2抗体进行RIP实验。
① 先在正常条件下进行RIP,验证Ago 2可结合目标RNA和miRNA,暗示目标miRNA和RNA与ceRNA机制有关;
② 然后过表达/抑制miRNA或靶mRNA,再进行anti-Ago2 RIP,检测RIP产物中富集的目标miRNA和RNA量是否随之变化。
③ 通过RNA pulldown(标签法)和荧光素酶报告基因实验可进一步验证miRNA-RNA的互作。
Q:RIP必须要用1×107细胞量吗?
A:推荐用1×107的细胞量,RIP理论上只下拉目标蛋白结合的RNA,产物RNA量较少,且RNA和蛋白内源性结合可能是暂时和少量的,如果细胞起始量少,下拉的目标产物会更少,影响下游分析。
Q:RIP抗体选择有什么要求?为什么要求IP和IgG抗体种属一致?
A:需选择IP级抗体,建议IP抗体和IgG抗体选择相同种属,如IP抗体是兔源,IgG也应选择兔源。IgG组是阴性对照也是同型对照,需与IP抗体同种属来源、同剂量、同亚型,以消除由于抗体非特异性结合而产生的背景信号。吉赛RIP试剂盒中提供了兔源的IgG,若需要需要其它种属的IgG也可以联系吉赛生物购买。
RIP试剂盒组分相关Q&A
Q:RIP试剂盒中各种Buffer的作用分别是什么?
A:Buffer A:用于细胞裂解;Buffer B:较弱的洗涤液;Buffer C:较强的洗涤液;Buffer D:磁珠封闭液;Buffer E:提取试剂;Buffer F:洗涤液1 ;Buffer G:洗涤液2。
Q:Buffer稀释和配置可以用常规的RNase free water吗?
A: 常规的DEPC水处理即可。
Q:RIP试剂盒的Buffer A和普通IP裂解液有什么区别?
A:RIP试剂盒用的裂解液是相对温和的,以免破坏细胞中蛋白和RNA的结合状态。
Q:RIP试剂盒中的裂解液能用针对膜蛋白的裂解液代替吗?
A:不能,膜蛋白裂解液作用效果较强,会破坏分子间的互作。吉赛RIP试剂盒不适用于膜蛋白的RIP。
Q:不小心把Buffer A和B放-20 ℃了,怎么办?
A:不影响Buffer使用,恢复正常温度储存即可。
Q:洗涤用的Buffer B和Buffer C能混用吗?
A:不建议混用,两者洗涤次数不一致。
Q:磁珠结团怎么处理?
A:实验前磁珠结团或分布不均匀,可采用涡旋打散,如果打不散可以采用低温超声2 min打散磁珠。实验中发现磁珠结团,可用移液枪吹打,或者涡旋;如果打不散,在抗原捕获过夜前可低温超声2 min打散磁珠。
Q:RIP试剂盒中提供的核酸吸附柱是一样的吗,为什么分开装呢?
A:吸附柱的滤芯是特异吸附核酸的,配合不同buffer处理可以特异性吸附DNA或者RNA,分开包装更方便按说明书操作。
RIP的蛋白产物分析相关Q&A
Q:WB分析RIP的蛋白产物,为什么Input、IP和IgG都有条带,且位置在约50 kDa处?
A:可能存在IP抗体的重链干扰;建议:① 选择不同种属的IP抗体和WB一抗,避免IP抗体的轻重链干扰;② 选择只与重链或轻链反应的二抗用于WB,如果目标蛋白分子量小于30 KDa,选择重链特异性二抗,以避免抗体轻链的干扰;如目标蛋白分子量大于30 KDa,选择轻链特异性二抗,以避免抗体重链的干扰。
Q:WB检测RIP的蛋白产物,结果异常,条带不符或无条带是为什么?
A:① 条带信号不足:样本量过多,裂解不充分,无法有效释放目的蛋白;样本量过少,蛋白含量过少,可增加或减少样本量;抗体用量不足,增加抗体用量。
②抗体未免疫沉淀到目的蛋白:检查是否使用正确的IP级抗体;用裂解物预检或取部分裂解物作为产物进行WB检测,验证抗体质量、裂解液裂解效果等;更换抗体。
③ 目的蛋白内源表达过低:增加样本量或过表达目的蛋白。
④ 蛋白降解:使用新鲜或冻存时间不长的样本,避免样本在常温放置过长时间;
⑤ 非特异性结合蛋白条带过多:减少孵育时间、增加洗涤次数。
RIP的RNA产物分析相关Q&A
Q:最后提取的RNA建议用多少水进行溶解?
A:一般建议用30 uL的水溶解,水过多会使RNA浓度太低,可能要浓缩后才能用于测序,会导致样本损失。
Q:Input组RNA含量高于IgG和IP组,能正常进行RNA产物等体积转录吗?
A:正常的,Input组是总RNA,含量较高;IP和IgG组是拉下来目标蛋白结合的RNA,含量较低。
Q:RIP产物检测不到RNA浓度,或者浓度很低,这是正常的吗?后续怎么做RT-qPCR?
A:RIP洗脱纯化的RNA产物量很少,基本上不足以直接准确测量出浓度。RIP产物RNA浓度通常Input组为50 ng/uL左右,IP组5-10 ng/uL左右。一般6 uL,正常进行逆转录。
Q:RIP-qPCR出不来结果或CT值都接近40,怎么办?
A:① 检查样本中目标蛋白和RNA的内源性表达量,若表达量较低,建议考虑过表达后再做RIP;
② 检查抗体是否IP级抗体及其特异性和活性;
③ 如果样本降解,建议重新准备样本和RIP实验,注意低温操作;
④ 可尝试加大起始细胞量,如加大到2×107或3×107细胞。
Q:RIP-qPCR结果IP和IgG组相差不大,这是什么原因呢?
A:① IP抗体失效:先WB验证RIP蛋白产物,确认IP组正常下拉目的蛋白,可正常富集蛋白结合的RNA;确认IgG组无下拉目的蛋白,不能富集蛋白结合的RNA。否则可能是抗体的问题,建议确认IP级抗体的特异性和活性。
②非特异性结合:若IP和IgG组均富集了相当量的目的RNA,可能存在非特异性结合,建议洗涤步骤采用较强的Buffer C,减少孵育时间,增加洗涤次数。
③ 在某些条件下目的蛋白与RNA不结合。
参考文献
[1]Yao ZT, et al. New insights into the interplay between long non-coding RNAs and RNA-binding proteins in cancer. Cancer Commun (Lond). 2022 Feb;42(2):117-140.
[2]Corley M, et al. How RNA-Binding Proteins Interact with RNA: Molecules and Mechanisms. Mol Cell. 2020 Apr 2;78(1):9-29.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn