
- 首页
- >
- GENESEED
- >
环状RNA:长期蛋白补充与精准治疗领域的技术突破与转化潜力
信使RNA(mRNA)疫苗与蛋白药物的成功极大推动了核酸药物与蛋白替代疗法的发展。然而,线性mRNA的稳定性和免疫原性以及外源蛋白本身的药代限制,仍然制约着长效、安全的蛋白替代治疗。近年来,环状RNA(circRNA)因其高稳定性、低免疫原性以及可持续驱动蛋白表达,被视为新一代蛋白替代疗法的重要平台。
circRNA:克服蛋白替代疗法核心限制的新平台
长期以来,蛋白疗法主要依赖外源蛋白或酶的直接补充(如酶替代治疗、重组凝血因子),但其半衰期短、需频繁给药;而以线性mRNA驱动体内蛋白表达(如mRNA疫苗或编码代谢酶的mRNA)则受限于mRNA稳定性不足、需复杂修饰与递送体系,并伴有免疫反应和较高生产成本等问题。
相比之下,环状RNA为共价闭合、无5′/3′端的单链RNA,天然稳定、难以被外切核酸酶降解,可实现更持久的体内蛋白表达。因此,circRNA被视为有望在多个需要持续蛋白补充的适应症中替代传统蛋白药和mRNA疗法,包括血友病、代谢性疾病与囊性纤维化等。

图1 由circRNA编码的多肽参与脂质代谢调控[1]
结构稳定,表达持久
线性mRNA易被外切核酸酶快速降解,即便经过帽子结构、poly(A)尾和修饰仍难以维持长期表达;相比之下,circRNA因无自由末端而具备显著更高的稳定性。
工程化circRNA在VLP/LNP递送下可产生更平滑、长尾的蛋白表达曲线,持续时间远超线性mRNA,并优于需频繁给药的外源蛋白疗法。
免疫原性低,安全性高
线性mRNA即使通过修饰减弱免疫激活,仍可能被TLR7/8、RIG-I等受体识别,引发免疫反应。相比之下,circRNA由于闭环结构接近内源RNA,具有更低的免疫原性,能够有效减少免疫激活和抗药抗体(ADA)风险。
翻译效率高,蛋白产量高
工程化circRNA通过优化5′/3′UTR、IRES元件及翻译适配体,能够大幅提升蛋白表达,并在体外和体内实验中优于相应mRNA。最新的自剪接/自环化技术与IRES调节策略,为高表达、持久型蛋白替代疗法提供了坚实基础。
可规模化生产
circRNA可通过自环化反应实现相对简化且可放大的制备流程。与需针对不同蛋白分别进行工艺优化的传统蛋白生产路径相比,circRNA平台具有更高的工艺通用性,可在既定体系内快速替换编码序列而保持生产流程的连续性与稳定性。
尽管circRNA作为治疗性RNA平台仍处于早期发展阶段,但已有多款药物进入临床试验,显示出其在安全性、稳定性与治疗持久性方面的潜在优势。
转录本生物推进的RXRG001是国际上首批进入临床的circRNA药物之一,已在2024年获得FDAIND批准,进入I/IIa期临床。这是circRNA在体内持续表达膜蛋白以修复器官功能的首个临床验证案例,为circRNA在蛋白替代疗法的实际可行性提供关键证据。
环码生物的HM2002是全球首批进入临床的circRNA注射液之一,已获得NMPA/FDAIND许可,目前处于临床I期。这是circRNA首次用于心血管疾病和组织再生领域的临床尝试,展示circRNA在大病种中的商业化潜力。
此外,最新研究显示,多支国内外团队已在骨关节炎、肿瘤、糖尿病创面与脊髓损伤、视网膜神经退行性疾病治疗、杜氏肌营养不良症治疗等模型中成功应用circRNA递送平台,实现优于线性mRNA的持续蛋白表达、组织修复与免疫调控效果,进一步确立了circRNA作为新一代治疗性RNA的跨疾病潜力。
1)在针对骨关节炎软骨退变机制的研究背景下,中国科学院分子细胞科学卓越中心与中南大学联合上海市第六人民医院团队利用circMSI2与circSOX5调控Musashi2等关键因子,显著改善软骨损伤并延缓OA进展。
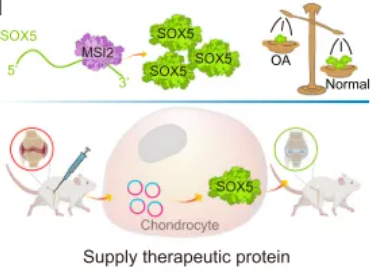
图2 基于ivcRNA的治疗通过补偿MSI2缓解DMM小鼠OA表型的示意图[2]
2)面对糖尿病溃疡修复缓慢的临床难题,南方医科大学团队利用LNP递送circFGF2,实现持续FGF2表达并显著加速创面血管生成与愈合。
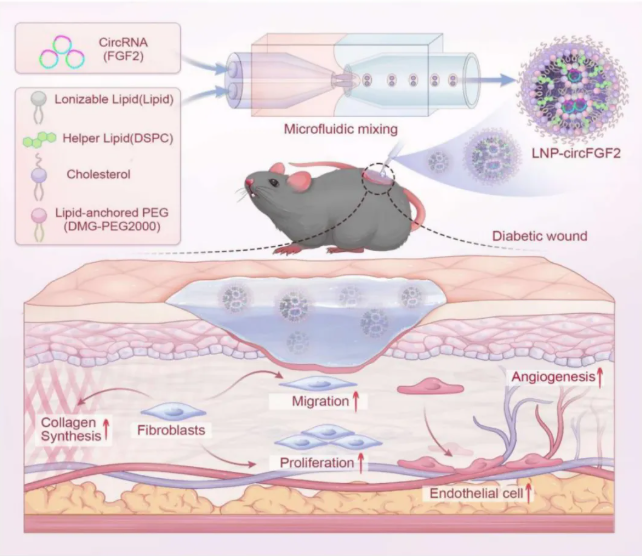
图3 基于环状RNA的治疗加速糖尿病创伤愈合示意图[3]
3)在脊髓损伤神经再生受限的背景下,美国伊坎西奈山医学院团队通过LNP递送circSox2、circAscl1与circGDNF,促进神经修复、降低瘢痕形成并恢复运动功能,疗效优于mRNA。
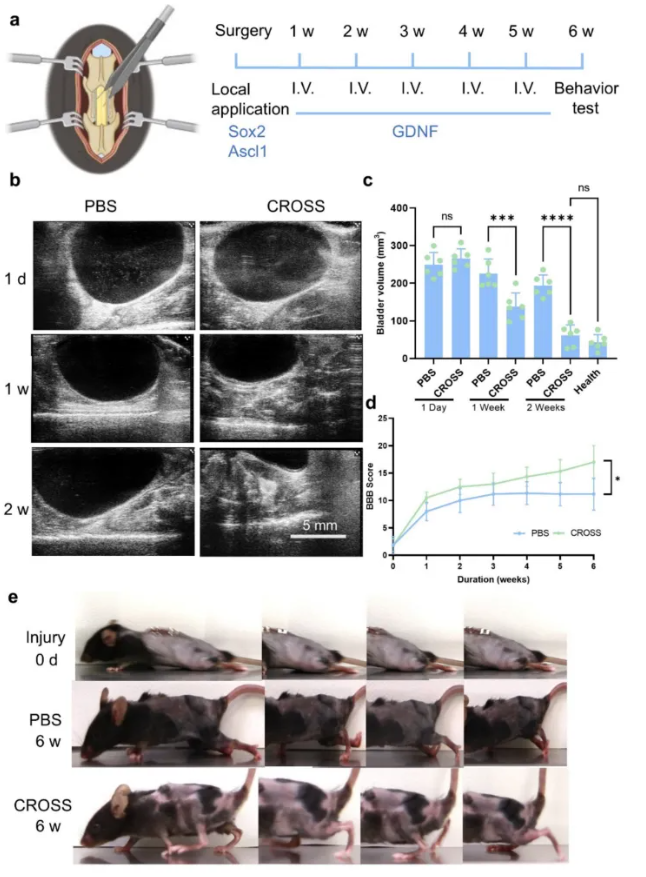
图4 脊髓损伤的小鼠经CROSS治疗后膀胱和运动功能恢复[4]
展望
总体而言,当前关于circRNA在蛋白替代疗法中的研究已从基础概念与体外验证,逐步走向动物模型和早期临床前平台。随着工程化技术、递送体系和安全性评估框架的成熟,circRNA有望在罕见病、慢性炎症与肿瘤免疫等多个领域,成为兼具高稳定性、低免疫原性和可编程性的蛋白替代新平台。
吉赛生物持续赋能circRNA疗法发展
吉赛生物已构建贯穿circRNA药物全链条的核心技术平台与服务体系——从靶点发现、序列设计,到成药性评价、工艺开发、质量研究直至GMP规模化生产,构建起真正的研发—生产一体化闭环。依托这一体系,吉赛生物为circRNA疗法的创新开发提供全程护航,加速前沿技术从实验室走向临床与产业化。


参考文献
[1] Han Y, Zhang YK, Li H, Ma Z, Wang Y. Peptide Drug: Design and Clinical Applications. MedComm. 2025;6:e70287. doi:10.1002/mco2.70287.
[2] Suo J, Li L, Tan W, Yin X, Wang J, Shao R, et al. Circular RNA-based protein replacement therapy mitigates osteoarthritis in male mice. Nature Communications. 2025;16:8480.
[3] Yao LY, Zhang Y, Shen YQ, Zhang RK, Yang B, Deng CC, et al. Circular RNA-based therapy provides sustained and robust expression of FGF2 to accelerate diabetic wound healing. J Control Release. 2025 Dec 10;388(Pt 2):114382. doi: 10.1016/j.jconrel.2025.114382.
[4] Li H, Zhang Y, Zhong Y, Guo K, Du S, Xue Y, et al. Aminophosphonate-derived lipid nanoparticles enable circular RNA delivery for functional recovery after spinal cord injury. Mater Today. 2025 Oct 16. doi:10.1016/j.mattod.2025.10.005. Epub ahead of print.

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn