
- 首页
- >
- GENESEED
- >
尼帕病毒再引关注:circRNA 或带来疫苗研发新思路
近期,尼帕病毒(Nipah Virus, NiV)在部分地区局部散发再次引起全球公共卫生领域的关注。NiV被世界卫生组织列为需优先推进研发的重点病原体,既往暴发显示其病死率较高且可引发严重神经系统与血管相关损伤。在缺乏获批疫苗及特异性抗病毒治疗的背景下,亟需可快速迭代的新型疫苗平台。 环状RNA(circRNA)由于其共价闭环结构,更耐受核酸酶降解,可支持较为持久的表达,其免疫激活强度也可通过序列与修饰策略进行调节,为开发应对此类高致病性病原体的新型疫苗提供了极具潜力的技术路径。 尼帕病毒入侵机制与免疫逃逸策略 尼帕病毒隶属于副黏病毒科,基因组为约18.2kb的单股负链RNA,编码包括核蛋白(N)、糖蛋白(G)、融合蛋白(F)等在内的6种关键结构蛋白。其致病性与受体介导的入侵过程及对宿主先天免疫反应的抑制密切相关。 G/F蛋白介导的受体依赖性入侵 尼帕病毒的入侵起始于G蛋白与宿主受体Ephrin-B2/B3结合,随后触发F蛋白构象转换并驱动膜融合,使核衣壳进入胞质。Ephrin-B2/B3在血管内皮细胞及神经系统组织中表达较多,这一受体分布与尼帕病毒感染中常见的血管损伤及脑炎等病理改变具有一定对应关系。 图1 尼帕病毒结构及其蛋白组成[1] 免疫拮抗与抗体逃逸相关因素 尼帕病毒的P基因相关蛋白(如V蛋白、W蛋白)可干扰JAK-STAT信号通路,从而抑制干扰素介导的先天免疫应答。此外,G蛋白表面的N-糖基化可影响中和抗体对关键表位的识别与结合,进而对免疫防护与疫苗设计提出挑战。 图2 尼帕病毒的病理生理学机制[2] 尼帕病毒疫苗研发的时效与长效挑战 既往疫情报道显示,尼帕病毒的病死率可达较高水平(约40%–75%,随暴发地区与医疗条件而异)[1]。面向此类高致病性病原体的疫苗研发,一方面需要具备在疫情出现时快速迭代与部署的能力,另一方面还需应对与其流行环境和防护目标相关的现实约束。 免疫保护的强度与持久性要求 在高病死率背景下,疫苗的保护效力不仅取决于诱导中和抗体的峰值水平,也取决于免疫反应的维持时间及记忆反应的可再激活性。以线性mRNA为代表的核酸平台在快速制备方面具有优势,但其体内表达持续时间有限,免疫学上需要加强免疫以维持保护性抗体滴度或巩固免疫记忆,因此需在免疫程序与免疫持久性之间进行优化。 热稳定性与储运条件的限制 尼帕病毒暴发多见于热带与亚热带地区,部分地区冷链与基层医疗条件受限。对温度敏感、依赖严格冷链的疫苗在推广接种中易受到运输、储存与末端配送环节的制约,从而影响覆盖率与接种时效。因此,提高制剂热稳定性并降低对超低温链的依赖,是面向尼帕病毒等病原体实现可及性与规模化应用的重要技术目标。

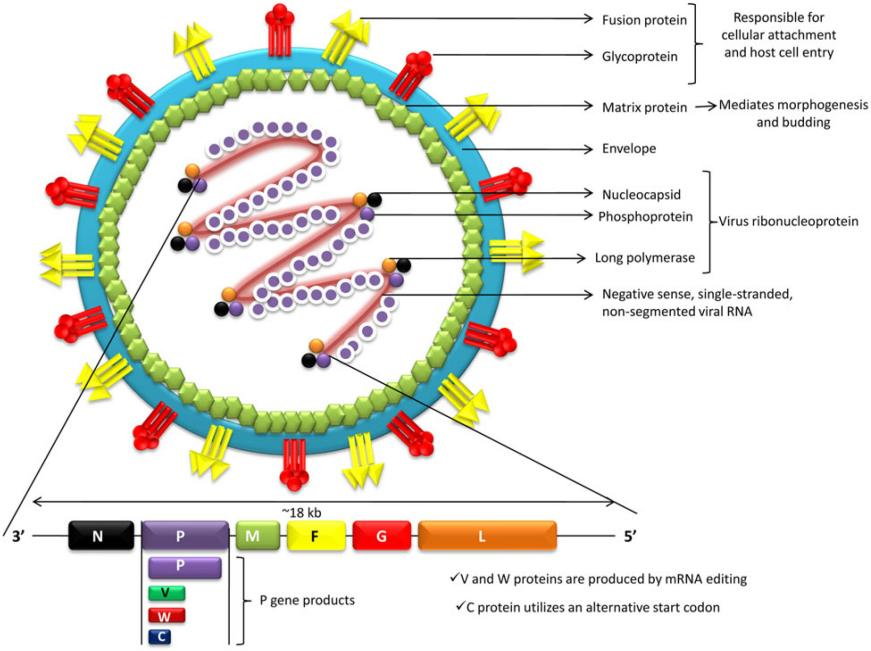
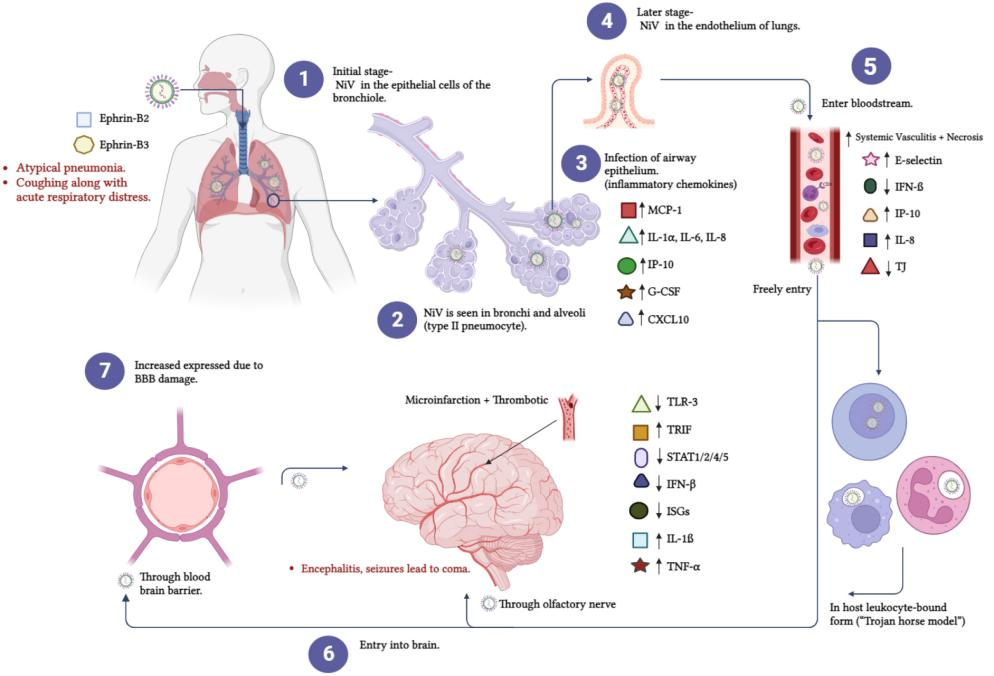


图3 尼帕病毒结构及其蛋白组成[1]

环状RNA疫苗的结构基础与功能特征

环状RNA为共价闭环构型的单链RNA分子。相较线性mRNA,其闭环拓扑结构在体内稳定性、蛋白表达持续性以及制剂保存条件等方面呈现不同的工程学表现,因此被纳入核酸疫苗平台的研究与评估体系。
体内抗降解能力与表达持续性
circRNA缺乏线性RNA常见的5′端与3′端结构,在细胞内不易受到外切核酸酶介导的降解,从而延长其作为翻译模板的有效存续时间。这一特性有助于延长RNA分子在体内的半衰期,为更持久的表达提供分子基础。
抗原表达效率与免疫呈递效应
在相同递送体系下,circRNA能在相对适中的剂量实现足够的抗原表达,可降低对高剂量核酸与载体材料的依赖,进而减少非特异性炎症反应与反应原性风险。用于尼帕病毒相关抗原(如G糖蛋白、F融合蛋白)时,更长且更稳定的抗原刺激有助于提高抗原呈递效率,促进体液与细胞免疫应答的建立与维持。
制剂储存稳定性与储运可行性
环状结构在分子层面通常具有较高的稳定性。研究显示circRNA-LNP在冷藏或中等温度保存时的稳定性优于线性mRNA,有助于降低对严格冷链条件的依赖,提升在资源受限地区的分发与接种可及性。

构建高效NiV circRNA候选疫苗的研发策略

针对尼帕病毒的circRNA疫苗研发,关键在于围绕序列工程化设计、环化效率提升与纯化/杂质控制建立可重复、可放大的技术路线,以获得稳定的体内表达并降低非目标免疫刺激的风险,研发路径通常包括以下环节。
抗原序列设计与免疫原性优化
候选抗原可聚焦尼帕病毒的G糖蛋白与F融合蛋白。序列设计需在保留关键抗原决定簇的前提下进行密码子与序列上下文优化,以改善翻译效率;并结合表位层面的筛选与组合,优化抗原呈递相关特征,从而提高免疫应答质量与一致性。
IRES元件适配与筛选
circRNA的蛋日表达主要依赖IRES介导的非帽依赖翻译起始。IRES活性受序列来源、上下游序列环境及细胞类型影响,需在候选IRES中进行筛选,并在与目标抗原序列相同构建背景下评估其起始效率与表达稳定性,以确定适配的元件组合并提升表达水平。
环化制备、纯化与工艺质量控制
高比例环化产物是实现稳定表达与规模化制备的基础,可通过优化环化反应条件提高环化效率与收率。纯化环节应重点去除残留线性RNA前体及相关副产物,因为此类杂质可能增强非特异性先天免疫激活并引入表达波动。围绕闭环比例、线性RNA残留与杂质谱建立可量化的质量属性与检测指标,有助于提高批间一致性并支撑工艺放大与GMP转化过程中的放行标准制定、稳定性评估以及不同批次/工艺变更的可比性研究。

吉赛生物:尼帕病毒circRNA疫苗
一体化解决方案

吉赛生物深耕circRNA科学研究与技术开发十余年,依托自主知识产权的成环策略,可提供circRNA序列设计、工艺开发、质量研究、规模生产、原料制备等一站式服务。面向尼帕病毒等高致病性病原体的候选疫苗开发,可在抗原构建与IRES元件筛选、环化与纯化工艺优化以及关键质量属性建立等环节提供平台化支持,推动候选分子由早期验证向工艺放大与制剂开发衔接。



结语

面对尼帕病毒等具有生物安全风险的病原体,前瞻性的技术储备是构建公共卫生防线的关键。circRNA 凭借其独特的闭环结构,在提升疫苗稳定性和长效表达方面展现出巨大潜力,已成为下一代传染病疫苗开发的核心路径。
依托深厚的 circRNA 技术积淀,吉赛生物致力于推动该平台由科研验证走向规模化生产。我们期待与行业并肩协作,以全流程工艺保障,为公共卫生防御体系提供更具潜力的技术方案。
参考文献
[1]Raj Kumar Singh, et al. Nipah virus: epidemiology, pathology, immunobiology and advances in diagnosis, vaccine designing and control strategies - a comprehensive review. VETERINARY QUARTERLY, 2019, https://doi.org/10.1080/01652176.2019.1580827
[2]Al-Obaidi MMJ, Muthanna A, Desa MNM. Nipah Virus Neurotropism: Insights into Blood-Brain Barrier Disruption. J Integr Neurosci. 2024. doi: 10.31083/j.jin2305090
[3]Siyun Yang and Supratik Kar, Are we ready to fight the Nipah virus pandemic? An overview of drug targets, current medications, and potential leads. Structural Chemistry, 2023. https://doi.org/10.1007/s11224-023-02148-6

 购物车
购物车


 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn