
- 首页
- >
- GENESEED
- >
IND背后:中国circRNA药物是如何跑通的?
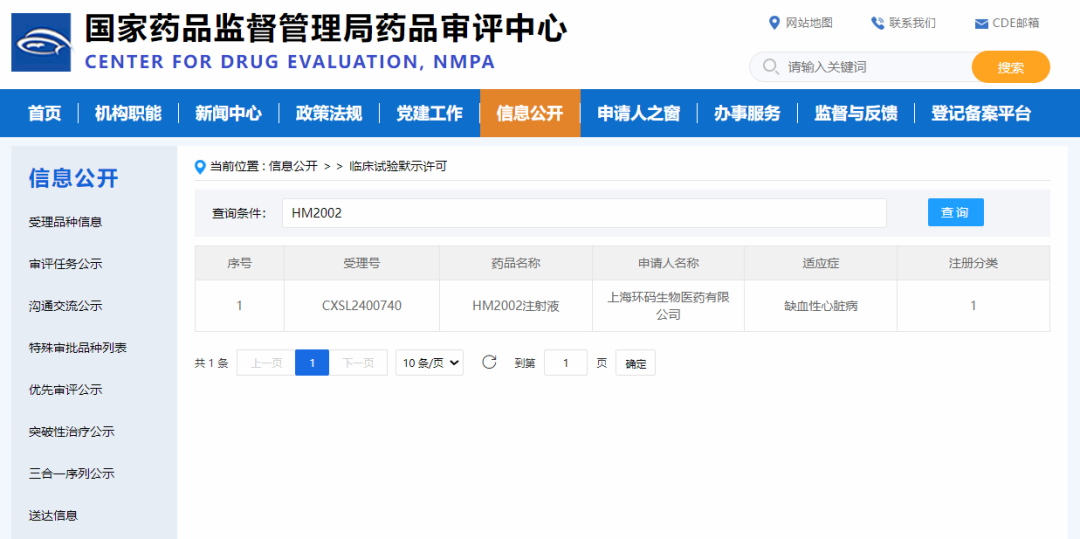
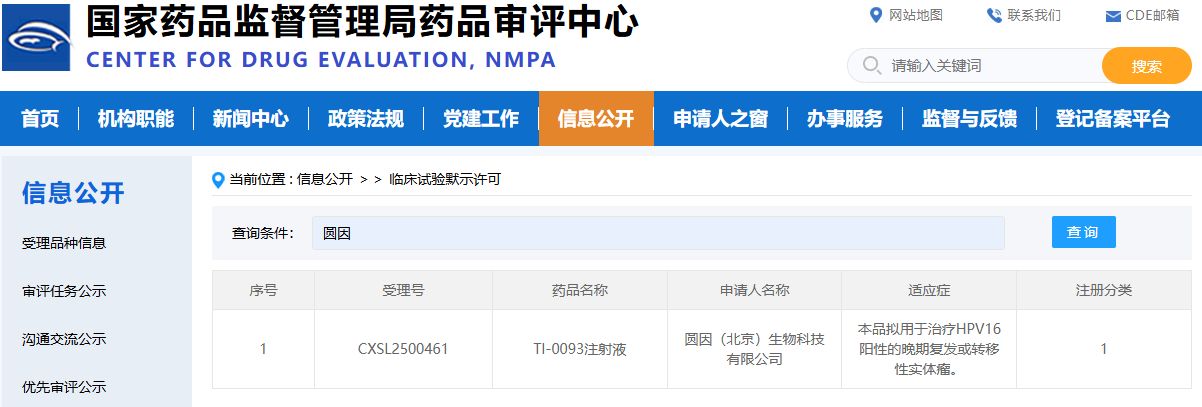
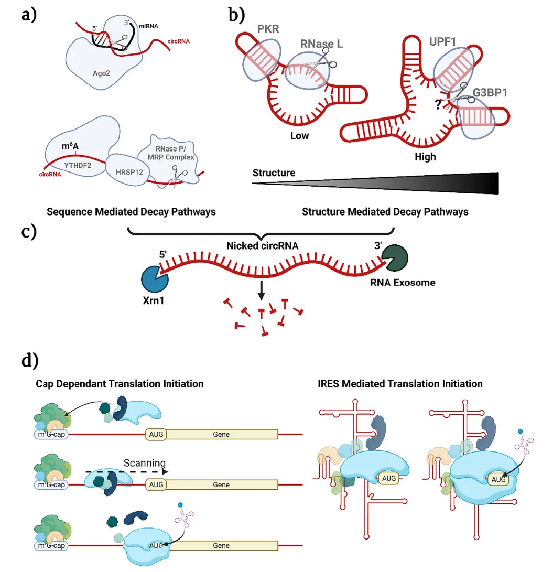
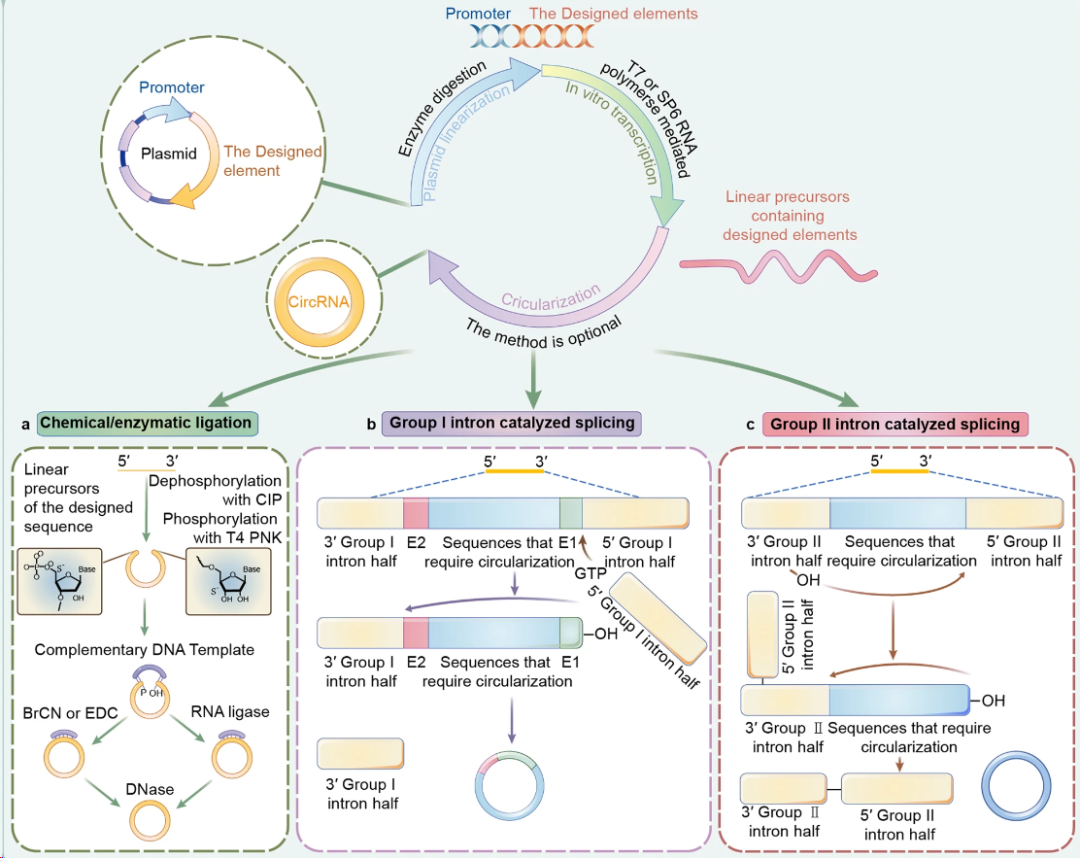
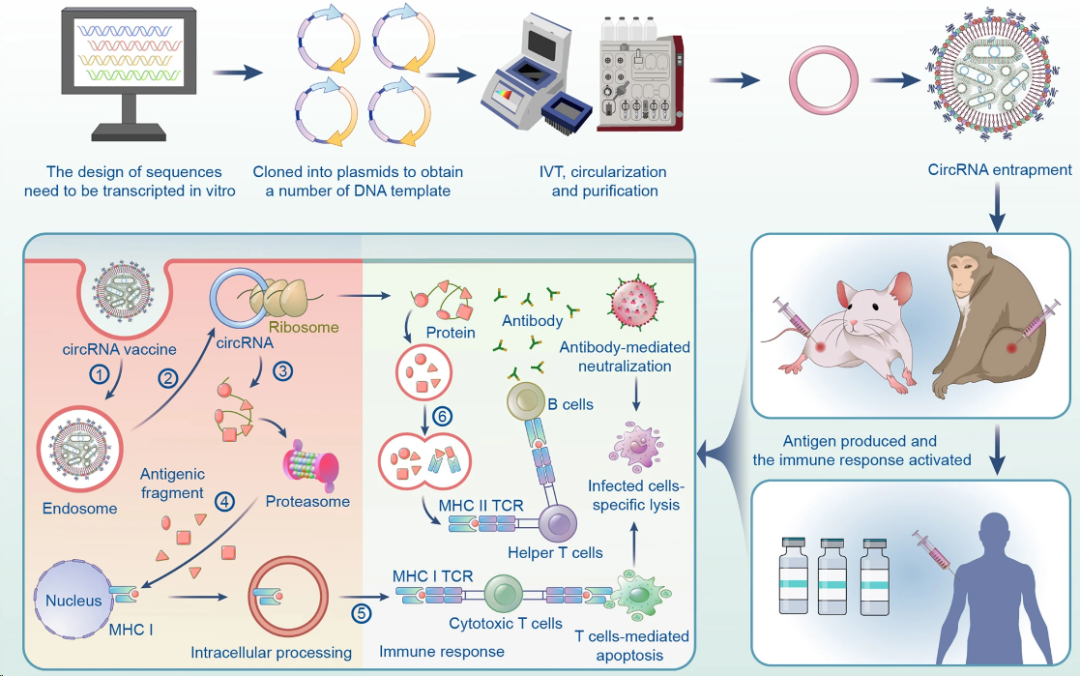
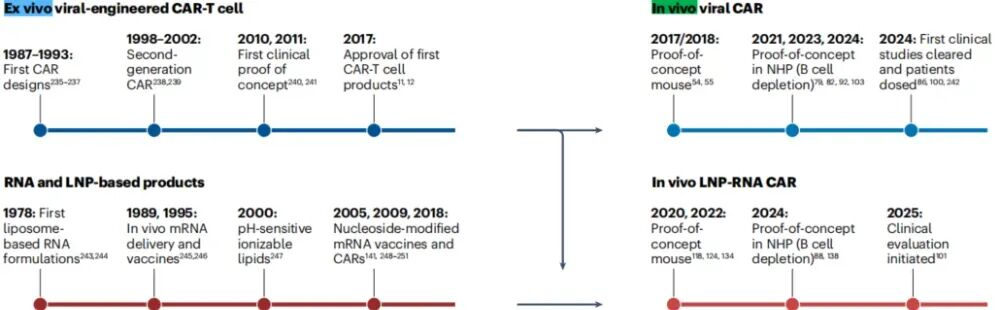
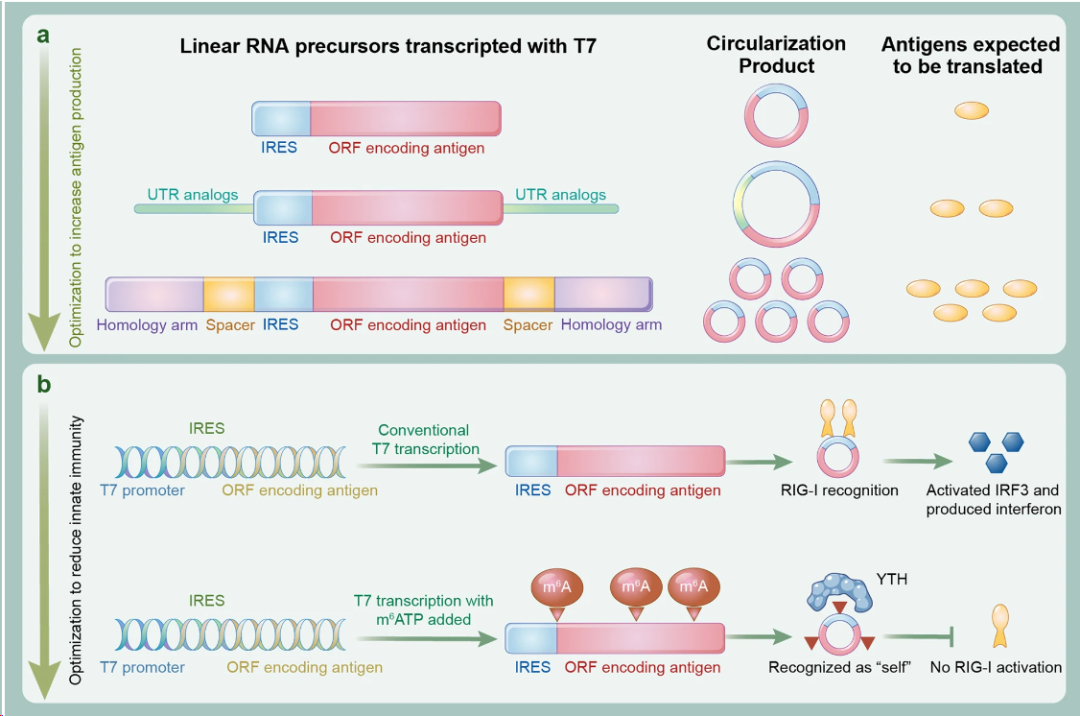
mRNA 疫苗的成功,验证了核酸药物的临床可行性,但线性 mRNA 在应用中仍受到体内稳定性有限、先天免疫激活等因素的制约。环状 RNA(circRNA)凭借其独特的共价闭环结构,天然具备抗降解、长效表达与可控免疫激活等优势,被视为下一代核酸药物的重要方向。 2024 年底以来,circRNA药物迎来历史性突破,转录本生物、环码生物、圆因生物三家中国企业,接连获得NMPA和FDA的新药临床试验许可(IND),成为全球首批将circRNA疗法推进至人体试验阶段的先行者。这不仅是三家企业的重要里程碑,更标志着circRNA技术首次在全球范围内完成从科学概念验证到监管申报落地的完整闭环。 差异化布局验证多维度成药潜力 三家企业的管线设计各具特色,分别从局部修复、慢病管理、肿瘤免疫三大方向切入,形成了差异化布局。 转录本生物(RiboX) 全球首个circRNA IND 2024年10月25日,转录本生物的核心产品RXRG001获得FDA临床试验许可,用于治疗头颈部肿瘤放疗后所致的口干症。这是全球首个获批进入临床阶段的circRNA疗法。RXRG001通过LNP递送系统,将编码人水通道蛋白hAQP1的circRNA靶向递送至唾液腺组织。非临床研究显示,单次给药即可实现唾液分泌功能显著改善,并持续超过4周。这一结果不仅验证了circRNA在局部组织蛋白替代中的可行性,更凸显其在提升患者生活质量这一高未满足需求领域的独特价值。 来源:RiboX官网 环码生物(Circode) 中美双报与大病种布局 2025年1 月 10 日与 5 月 30日 ,环码生物的HM2002注射液先后获得NMPA和FDA的IND批准,首发适应症为缺血性心脏病,并进一步拓展至难治性心绞痛与慢性冠脉综合征。该疗法采用术中局部注射策略,在心脏搭桥手术期间直接将编码血管内皮生长因子(VEGF)的circRNA注入心外膜,促进血管新生并改善心肌灌注,从而加速心功能恢复。2026 年 1 月 29 日,该药物进一步获得 FDA 授予的“快速通道”资格(Fast Track Designation),有望通过更频繁的监管沟通与潜在加速机制缩短上市进程。 另一管线HM2003获得FDA授予的孤儿药资格,致力于为血栓闭塞性脉管炎患者提供创新的治疗选择。环码的策略,清晰指向心血管慢病与罕见血管病的长期管理。 来源:CDE官网 圆因生物 (Therorna) 拓展实体瘤免疫治疗 2025年8月22日,圆因生物的TI-0093注射液获CDE默示许可,即将在HPV16阳性的晚期复发或转移性实体瘤患者中开展I期研究。该药物利用circRNA编码HPV16 E6/E7肿瘤相关抗原,旨在激活抗原特异性CD8+ T细胞应答。相较于线性mRNA,circRNA疫苗可诱导更强效、更持久的T细胞扩增与记忆形成。若临床验证成功,这将是circRNA在肿瘤免疫治疗领域的重大突破,也为个性化癌症疫苗开辟新路径。 来源:CDE官网 circRNA的成药优势正在兑现 过去,circRNA常被视为“有潜力但难成药”的前沿技术。如今,IND接连落地,背后是其核心优势正逐步转化为可工程化、可放大、可监管的药物属性。 蛋白表达的长效性 得益于闭环结构对核酸外切酶的高度抵抗,circRNA在细胞内半衰期显著延长。研究显示,在糖尿病足溃疡、骨关节炎、脊髓损伤等动物模型中,单次给药可持续表达目标蛋白10天以上,部分研究甚至观察到4-6周的效应[1-3]。通过降低给药频次,显著改善患者的治疗负担,这对需长期干预的慢性病具有革命性意义。 circRNA的降解和翻译[4] 免疫原性的可控性 circRNA的共价闭环结构天然缺乏5′三磷酸末端,无法被RIG-I/MDA5等先天免疫受体识别,从源头降低干扰素激活风险。其实际免疫原性主要源于制备过程中残留的dsRNA等杂质。通过优化合成与纯化工艺,可显著降低杂质水平,有效抑制非特异性免疫反应。这一“结构低免疫+工艺高可控”的双重优势,显著提升给药安全性。 体外转录(IVT)技术及circRNA合成的示意图[5] 储运条件的稳定性 环状结构在分子层面通常具有较高的稳定性。在特定的制剂与递送体系下,circRNA药物有望在2-8℃条件下保持稳定数周,部分冻干剂型甚至具备室温短期储存潜力。这一特性将大幅降低对超低温冷链的依赖,提升药物在基层医疗和资源有限地区的可及性。 生产工艺的降本潜力 circRNA无需5′加帽与poly(A)尾修饰,可显著精简制备流程。尽管当前环化效率与大规模纯化仍是工艺挑战,但随着生产工艺的持续优化、关键原材料成本下降以及制造规模扩大,其GMP生产成本有望逐步降低。 应用全景:从基础机制走向多场景转化 2025 年,环状 RNA应用研究报道增多,研究重点由早期的稳定表达验证逐步转向面向具体应用场景的系统性验证评估。 基因调控 在基因调控研究中,circRNA 由于其结构的稳定性和模块化设计特性,成为一种具有调控潜力的工具。通过 RNA–蛋白互作、RNA 修饰调控、miRNA 海绵效应和反义抑制翻译等机制,circRNA 已被应用于细胞和动物模型中,以实现对特定信号通路或病理进程的精准干预[6-9]。与小分子、siRNA 或 CRISPR 等传统基因调控策略相比,circRNA 在表达持久性、靶向特异性和可控性方面具有优势,为肿瘤、神经退行性疾病、免疫相关疾病以及遗传性疾病等领域提供新的干预策略。 推荐阅读: 姚红红团队开发鼻内给药的circSCMH1@LNP有效治疗缺血性脑卒中。 陈玲玲/邹卫国团队构建双链环状 RNA 适配体 circPOLR2A(9,10)缓解小鼠骨关节炎症状。 单革团队揭示静脉注射LNP-mecciND2 抑制 mPTP 开放保护心脏功能。 彭勇团队发现 circRNA 适配体 circRNA-BISC 阻断 c-MYC 翻译并缓解三阴性乳腺癌耐药。 传染病疫苗 在传染病疫苗研究中,circRNA 作为抗原编码载体,通过 LNP 等递送体系,结合肌内、皮下和气道/肺部等不同给药途径,系统评估免疫原性、保护效力和安全性,其闭环结构提高了抗原表达的稳定性,延长了免疫应答的持续时间,有助于减少重复给药负担[10-12]。围绕 circRNA 疫苗的开发,技术链条逐渐形成,涵盖环化效率、纯化策略、递送系统优化(如 LNP 组分、粒径与电荷)以及免疫效应评估。随着工艺可重复性和质量控制(如 dsRNA 杂质控制、批间一致性等)的纳入,circRNA 疫苗的研究正从“有效性”向“可生产、可验证、可比较”发展,为疫苗的规模化生产与临床应用奠定基础。 推荐阅读: 朱贵志联合张煜团队开发吸入式 circRNA-M2e 疫苗,保护效果优于线性 mRNA。 高福、刘志达、王寒团队开发 circRNAB6M1 实现交叉保护和强效免疫应答。 苏州大学与科锐迈德开发 SARS-CoV-2 Delta circRNA 疫苗 cmRNA-1130 提高递送与免疫应答。 circRNA疫苗的制备[5] 肿瘤免疫 肿瘤疫苗研究主要以肿瘤抗原(如模型抗原、病毒相关抗原或新抗原)为核心,重点评估 IRES/UTR 设计、APC 递送效率,以及 T 细胞应答的强度与持续性。部分研究已进入临床试验,并以安全性、耐受性和免疫原性为主要评估终点[13-17]。由于其稳定的表达特性,circRNA 在肿瘤疫苗的应用中有助于延长抗原呈递的时间,减少非特异性炎症反应,从而增强并维持抗肿瘤免疫反应。circRNA的可编程性支持新抗原组合和多价策略,并为与免疫检查点抑制剂等联合疗法提供灵活应用的基础,以应对实体瘤的异质性和免疫耐受性带来的治疗挑战。 推荐阅读: 谭蔚泓/谢斯滔团队开发 Apt-circRNA 肿瘤疫苗,与 PD-1 抑制剂联用增效并验证安全性。 黄胜林与方主亭团队优化 IRES 提升 circRNA 肿瘤疫苗疗效。 朱贵志团队开发小型短肽 circRNA 疫苗,增强 T 细胞应答并优化递送效果。 林欣团队开发LNP-circRNA 疫苗,增强肺部肿瘤清除与 CAR-T 联合疗效。 细胞免疫疗法 (CAR-T / CAR-NK / CAR-M) 在细胞免疫疗法中,circRNA 主要用于编码 CAR 结构及共刺激模块等功能元件,通过体外电穿孔或体内 LNP 递送生成效应细胞,并在疾病模型中评估 CAR 表达的持续时间、细胞效应功能与治疗效果[18-21]。其优势在于提供持久表达,并减少病毒载体带来的基因整合风险,从而为“按需表达、可重复给药”的治疗策略提供可行性。尤其在体内原位生成 CAR 的策略中,circRNA 平台有望简化细胞制备流程,缩短周转时间,提高治疗的可及性,推动细胞免疫治疗的标准化、规模化发展,并拓展在更多适应症中的应用。 推荐阅读: 璩良联合徐沪济团队用免疫亲和 LNP 递送 circRNA 实现 B 细胞清除。 姜新义等团队构建水凝胶+mLNP 双递送体系,生成 CAR-巨噬细胞特异性杀伤实体瘤。 邱满堂、王俊联合孙明团队用 circRNA 构建 CAR-T,疗效优于 mRNA-CAR-T 在小细胞肺癌模型中的表现。 Chang-HanLee联合MihueJang团队通过电穿孔递送 CAR-MS10 circRNA 生成 circCAR-NK,抗肿瘤活性优于线性 mRNA。 蛋白替代疗法 蛋白替代疗法侧重于在局部组织或靶向递送条件下,实现修复因子、再生因子或抗炎蛋白的持续表达,并以表达持续性、组织功能恢复和安全性为主要评价指标[22-25]。由于circRNA 表达稳定,能够在局部实现较长时间的治疗蛋白暴露,从而降低给药频率并提高患者依从性。同时,局部或定向递送可提高药物的有效浓度,减少全身性暴露,降低系统性不良反应风险。因此,circRNA 在慢性疾病管理和组织修复等需要持续疗效和高安全性的临床场景中具有较好的应用前景。 推荐阅读: 连继勤团队用 LNP 递送 circCDUPRT 与 circIL-15 提高黑色素瘤抗肿瘤效果。 董一洲联合Chun-Wan Yen团队开发CROSS系统,改善脊髓损伤小鼠膀胱与运动功能。 邹卫国、Youkui Huang、雷光华、Jinlong Suo团队递送 ivcRNA 缓解骨关节炎并延长蛋白表达时间。 Chongfei Yang、罗钰、Qinhao Wang团队开发 circ-srIκBα@LNP-SHC 促进软骨修复。 除了上述方向,circRNA 应用研究还在基因编辑、生物传感器、细胞因子免疫疗法、免疫检查点调控与干细胞重编程等领域持续扩展[26-30]。整体趋势表明,circRNA 正从“表达工具”逐步发展为与递送材料、免疫调控和细胞工程深度结合的平台技术,既能推动精准治疗的实现,也为早期诊断、个体化治疗和组织功能重建提供新的解决方案与转化路径。 未来五大方向定义下一阶段产业机会 体内原位 CAR-T 的可行性与可控性 传统 CAR-T 疗法依赖体外制备与回输,制备周期长、成本高,限制了规模化应用。采用 LNP 递送 circRNA 的体内原位重编程策略,旨在在机体内诱导免疫细胞表达 CAR,从而减少体外环节,并为通用型治疗模式提供可能。环码生物与北京大学已在小鼠肝纤维化模型中获得概念验证(POC)结果。但该技术的临床转化仍需重点解决递送细胞类型选择性(更精准指向 T 细胞)、建立可预测的剂量—表达强度/持续时间关系以实现动力学可控,以及完善安全性窗口评估并验证重复给药的可行性等问题。 推动In vivo CAR-T实现临床转化的重大发现及里程碑事件[31] AI /计算驱动的序列理性设计 传统 circRNA 优化多依赖随机文库筛选,但翻译效率受 IRES、UTR 与连接区等元件的组合效应影响,导致筛选成本高、收敛慢且难以形成可复用规律。近年以 GEMORNA(MIT/哈佛)等为代表的计算驱动模块化设计显示可提升蛋白产量,推动研发从“筛选为主”转向“设计—验证闭环”。但要实现临床与产业化转化仍取决于三个关键点:跨细胞/递送体系的可迁移性、模型预测与湿实验的一致性与可复现性,以及将免疫刺激与安全性作为联合约束纳入优化框架。 circRNA设计[5] 从罕见病向常见慢病的适应症拓展 circRNA 的潜在优势在于蛋白表达窗口相对更长,因而更契合需要持续干预与长期管理的慢病治疗场景,产业界已在心血管、代谢等领域布局,学术界也在骨关节炎、糖尿病足等模型中观察到持续治疗效应。后续转化的关键仍在于系统验证慢性病场景所需的长期安全性与免疫耐受、重复给药的可行性及其对疗效的影响,并建立可支撑规模化应用的成本与支付模型。 治疗心肌梗死的环状RNA局部递送示意图[31] circRNA 介导的编辑工具长效递送 将基因编辑工具进行载体化递送时,更长的表达与作用窗口在特定情境下具有明确的工程意义。对于 Cas 系统或 RNA 编辑体系,延长效应持续时间可能提高细胞内达到有效编辑的概率,并在给药时机与剂量设定上提供更大的操作空间。 非肝靶向 LNP 递送的组织 选择性规模化制造 主流 LNP 递送体系多呈肝脏富集特征,限制了其在肺、脾及中枢等非肝靶器官场景中的应用。为实现更广泛的组织覆盖,研究重点转向组织选择性配方的规模化开发与端体逃逸效率提升。该方向正从“概念可行”进入“工艺路线竞争”,后续仍需解决跨物种可转化性、长期安全性与重复给药,以及规模化生产与质量控制约束下的可制造性与一致性问题。 结语 随着环化工艺、纯化策略与递送技术的持续突破,circRNA 研发正由动物与体外概念验证阶段迈向更具可转化性的工程化开发。中美同步申报路径的明晰,进一步加速了其临床转化节奏。尽管早期研究数据初步验证了安全性,circRNA的真正价值——是否在疗效持久性、给药频率或适用人群上显著优于现有平台——仍有待严谨的临床研究回答。随着临床数据的持续读出与验证,circRNA 有望突破现有核酸药物的边界,成为继 mRNA 之后,进一步拓展生物医药版图的下一代核心技术平台。 参考文献

 购物车
购物车




 广州市黄埔区开源大道11号科技企业加速器A区6栋2楼
广州市黄埔区开源大道11号科技企业加速器A区6栋2楼


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn